葡萄膜炎是指一组以葡萄膜炎症为特征的眼部疾病,涵盖虹膜、睫状体和脉络膜。葡萄膜炎是导致失明的第四大原因,占美国失明患者的 10%。免疫治疗是导致药物性葡萄膜炎增加的原因之一,在接受免疫肿瘤治疗的患者中,有高达 70% 的患者出现眼部副作用,包括 VEGFR、EGFR、肿瘤特异性蛋白抑制剂,以及雌激素受体调节剂、干扰素和检查点抑制剂等。因此,为了开发眼科药物和研究眼部毒性,迫切需要与人类高度相关的眼部组织模型。
脉络膜(Choroid)位于视网膜和巩膜之间,是一个薄薄的、高度血管化的色素组织。负责满足视网膜外部对营养供应和清除有毒代谢产物的需求。由于免疫系统的物种差异,将研究结果(例如,从非人类灵长类动物中)转化到患者中可能会受到阻碍,急需开发先进的基于人体和具有免疫功能的眼脉络膜体外模型来研究血管网络与人体免疫系统之间的相互作用。这样的模型可以支持对药物引起的葡萄膜炎的早期检测和新治疗策略的发现。

2022 年 1 月 13 日,图宾根大学和罗氏制药联合研究团队在 Communications Biology 杂志上发表了题为“人类免疫功能性脉络膜芯片:研究生物药物眼部效应的新工具”的研究论文。该研究报告了人类免疫活性脉络膜芯片(Choroid-on-Chip, CoC)的开发,这是一种基于人类细胞的体外脉络膜层模型,整合了黑色素细胞和微血管内皮细胞,覆盖有一层视网膜色素上皮细胞。该模型的免疫功能是通过灌注外周免疫细胞来实现的。为了研究免疫抑制化合物的疗效测试以及免疫激活抗体的安全性分析的适用性,将 CoCs 暴露于环孢菌素并测试了 CD3 双特异性抗体。

为了模拟人类脉络膜的组织复杂性,该研究设计了一个 3 通道的微流控平台,允许灌注循环免疫细胞。脉络膜芯片包含三个主要的细胞成分(图 1a-c)。上皮由顶部通道中的人类诱导多能干细胞(iPSC)衍生的视网膜色素上皮(retinal pigmented epithelium, RPE)单层组成。内皮由两层汇合的人类原代脉络膜毛细血管微血管内皮细胞(microvascular endothelial cells, MVECs)单层组成,这些单层接种在中央通道中,RPE 在上侧,黑色素细胞隔室在下侧。该通道使用注射泵以 40 µL/h 的流速灌注。底部通道中的基质成分具有载有细胞的水凝胶,该水凝胶在 3D 排列中以规定的细胞密度掺入黑色素细胞(图 1d)。细胞被均匀地播种,并在整个芯片长度上分布成一个色素组织(图 1e)。
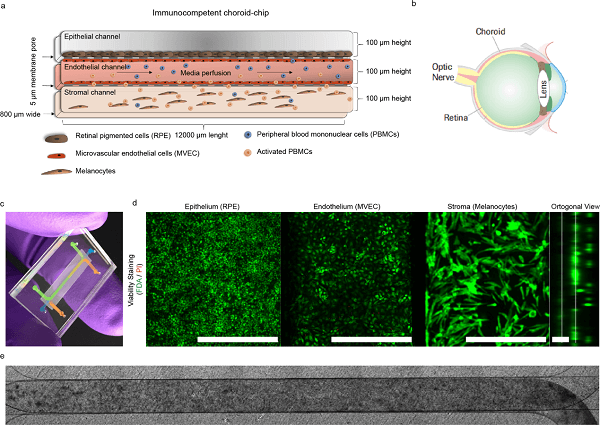 图1. CoC 模型的概念。
图1. CoC 模型的概念。
为了模拟外血视网膜屏障(outer blood-retina barrier, oBRB),RPE 和 MVECs 分别在上膜的两侧、顶部和底部培养(图 1a)。膜涂有层粘连蛋白、胶原蛋白和纤连蛋白,以模拟 Bruchs 膜组合物。RPE 在整个芯片中形成了一个色素单层,表达紧密连接蛋白 zonula occludens 1(ZO-1)和酪氨酸酶相关蛋白 1(TYRP1),参与黑色素的生成(图 2a)。MVEC 在整个内皮通道内形成汇合和 CD31 阳性单层(图 2b); CoC 中的内皮层呈 ZO-1 阴性。为了进一步评估该模型如何模拟 oBRB,研究人员评估了内皮层对 RPE 侧(oBRB)和组织基质侧的渗透性(图 2c)。数据显示,在所有条件下,羧基荧光素(0.377 kDa)和葡聚糖德克萨斯红(70 kDa)在细胞单层的存在下均保留。oBRB 的保留率高于内皮-基质屏障(2 倍)。
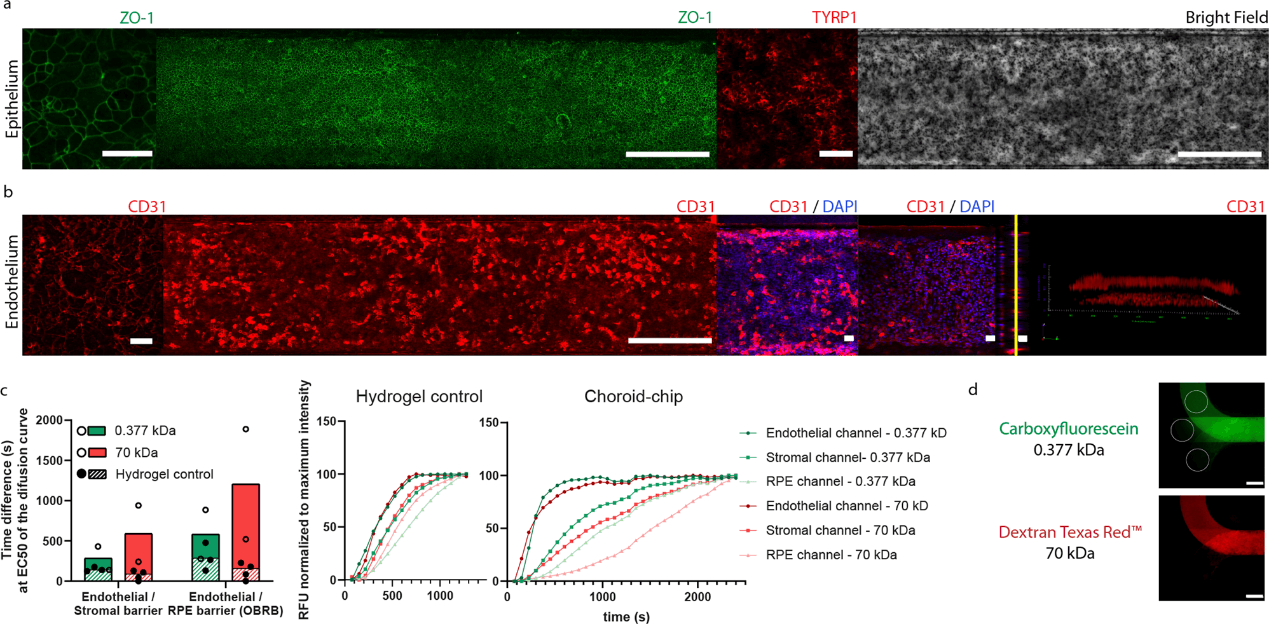 图2. 培养 2 周后的内皮和外血视网膜屏障(oBRB)表征。
图2. 培养 2 周后的内皮和外血视网膜屏障(oBRB)表征。
CoC 中的黑色素细胞接种过程旨在实现两种不同的黑色素细胞密度,5% 和 50%(图 3a,3b)。在培养 2 周后,对两种密度的黑色素细胞的形态、色素沉着、增殖(Ki-67)和活力进行了表征(分别为图 3a,3b)。通过黑色素自体荧光成像和这些细胞中 TYRP1 的存在证实了三维细胞分布和黑色素的活跃产生(图 3c)。有趣的是,用高密度和低密度黑色素细胞培养的芯片之间的主要功能差异在于 IL-6,与黑色素细胞密度成比例分泌,与促炎细胞因子 TNF-α 的分泌相反(图 3d)。
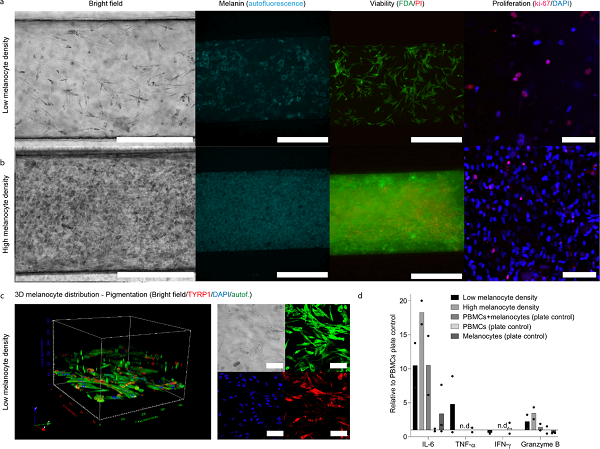 图3. 培养 2 周后黑色素细胞区块的特征。
图3. 培养 2 周后黑色素细胞区块的特征。
葡萄膜黑色素细胞的大小和色素沉着因种族和物种而异,CoC 旨在分别以低和高的黑色素细胞密度分别重现这些细胞差异性,从而解决非临床药物开发中可能存在的物种差异。不同的黑色素细胞密度伴随着黑色素含量的差异,具有药理学意义,例如小分子药物与黑色素的结合以及不同的 IL-6 水平。IL-6 由黑色素细胞和 RPE 分泌,是眼部免疫状态的关键细胞因子,参与维持葡萄膜组织的平衡。IL-6 在眼部疾病中也起着核心作用:已发现眼内 IL-6 水平在葡萄膜炎、AMD 和糖尿病眼病等多种视网膜疾病中升高。此外,IL-6 和 TNF-α 是在对照组人类玻璃体中检测到的仅有细胞因子,这与该模型中低黑素细胞密度条件下的细胞因子谱相吻合(图3c)。因此,该模型可用于进一步的研究。
为了将免疫成分整合到 CoC 中,将新鲜分离的人外周血单个核细胞(peripheral blood mononuclear cells, PBMC)通过内皮通道灌注。灌注过程和参数经过仔细选择,以确保细胞活力,同时避免免疫细胞激活,因为这可能会导致不受控制和预期外的免疫细胞反应(图 4)。最初在无细胞芯片中评估了免疫细胞粘附在膜上并向黑色素细隔室迁移的能力。研究人员将 PBMCs 和激活的 T 细胞("Act",用抗 CD3/CD28 抗原处理过)通过含有裸水凝胶或补充了 CCL19 的水凝胶的芯片灌注,CCL19 是一种负责引导 T 细胞从血流进入淋巴结的趋化因子。在没有 T 细胞活化和 CCL19 的情况下,几乎没有免疫细胞出现在黑色素细胞区,而在存在 CCL19 和 T 细胞活化的情况下可以清楚地观察到细胞募集(图 4a)。
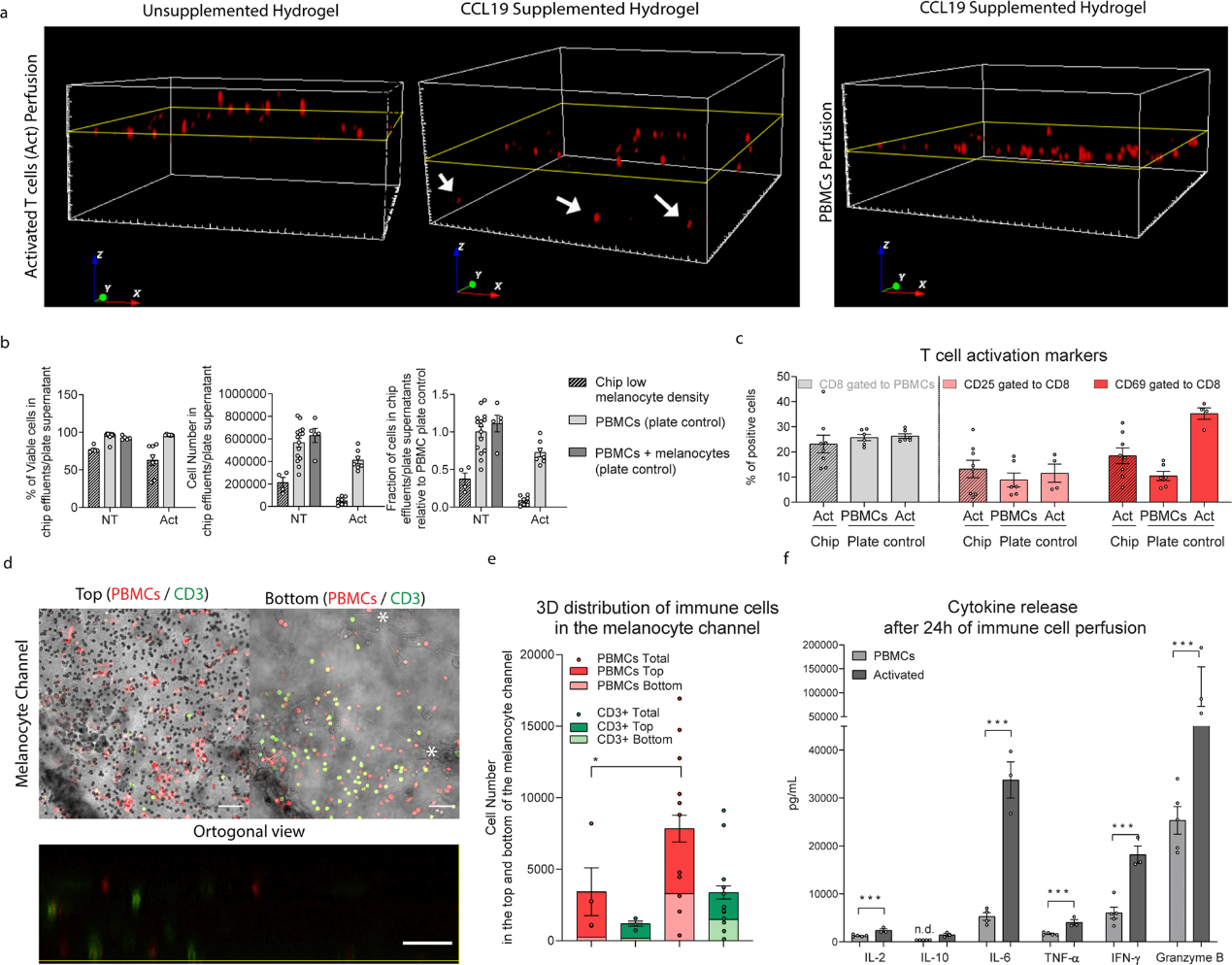 图4. 用抗CD3/CD28抗原(Act)激活后验证 PBMC 的灌注、活力、招募和细胞因子释放。
图4. 用抗CD3/CD28抗原(Act)激活后验证 PBMC 的灌注、活力、招募和细胞因子释放。
在第二步中,通过完全组装的 CoC 灌注 PBMCs 并激活 T 细胞,以更好地了解免疫细胞募集到黑色素细胞室中,并评估 T 细胞激活是否会模拟葡萄膜炎的疾病表型。线性灌注 24 h 后,超过 50% 的灌注免疫细胞留在芯片中(图 4b);此外,流出物中的细胞没有增殖。PBMCs 和活化的 T 细胞的细胞活力均保持在 75% 以上。芯片流出物中活化标志物 CD69 阳性的 T 细胞的比例比平板对照组低两倍(图 4c)。与此相反,T 细胞活化的后期标志物 CD25 并没有因活化而改变,这可能是由于 24 h 的活化时间太短。这表明活化的细胞留在芯片中,粘附到内皮或向其他隔室迁移,这也通过整个芯片的定量图像分析和芯片流出物中细胞因子的测量所观察到的。用 CD3/CD28 抗原处理导致 PBMC 和 T 细胞迁移增加,特别是向黑素细胞区室的下半部迁移(图 4d,4e)。T 细胞活化导致所有测试细胞因子水平持续升高。IL-10 在 PBMC 中未检测到,在活化细胞中检测到低浓度,与 24 h 的早期时间点一致(图 4f)。IL-6 在存在细胞外基质的情况下介导 T 细胞迁移,需要整合素信号转导通路和趋化迁移的梯度。因此,IL-6 的增加可以解释免疫细胞募集的增加。
该研究使用常见的免疫抑制剂环孢菌素 A(Cyclosporine A, CsA)评估了 CoC 对免疫调节刺激作出特异性反应的能力。将 CoCs 暴露于不同剂量的 CsA,同时灌注通过抗 CD3/CD28 抗原激活的 PBMC。CsA 处理没并有显著影响免疫细胞活力(图 5a)。然而,CsA 处理的 CoC 的流出物中的细胞回收率显著高于活化 T 细胞或 PBMC 的对照(图 5b)。CsA 的免疫抑制作用表现为 CD8a 阳性细胞中CD69的表达减少,两种浓度均具有统计学意义(图 5c),芯片中所有测量的细胞因子均降低(图 5d),平板对照中除了 IL-2,其他都降低(图 5e)。在高 CsA 条件下,芯片中由 T 细胞活化引起的 IL-2 增加在芯片中略有逆转,但在平板对照中没有。重要的是,这些影响与 CsA 浓度依赖性免疫细胞募集减少相关。相对于活化的 T 细胞,用高浓度 CsA 处理使免疫细胞的浸润逆转了 2 倍,相对于低 CsA 条件逆转了 1.8 倍(图 5f,5g)。
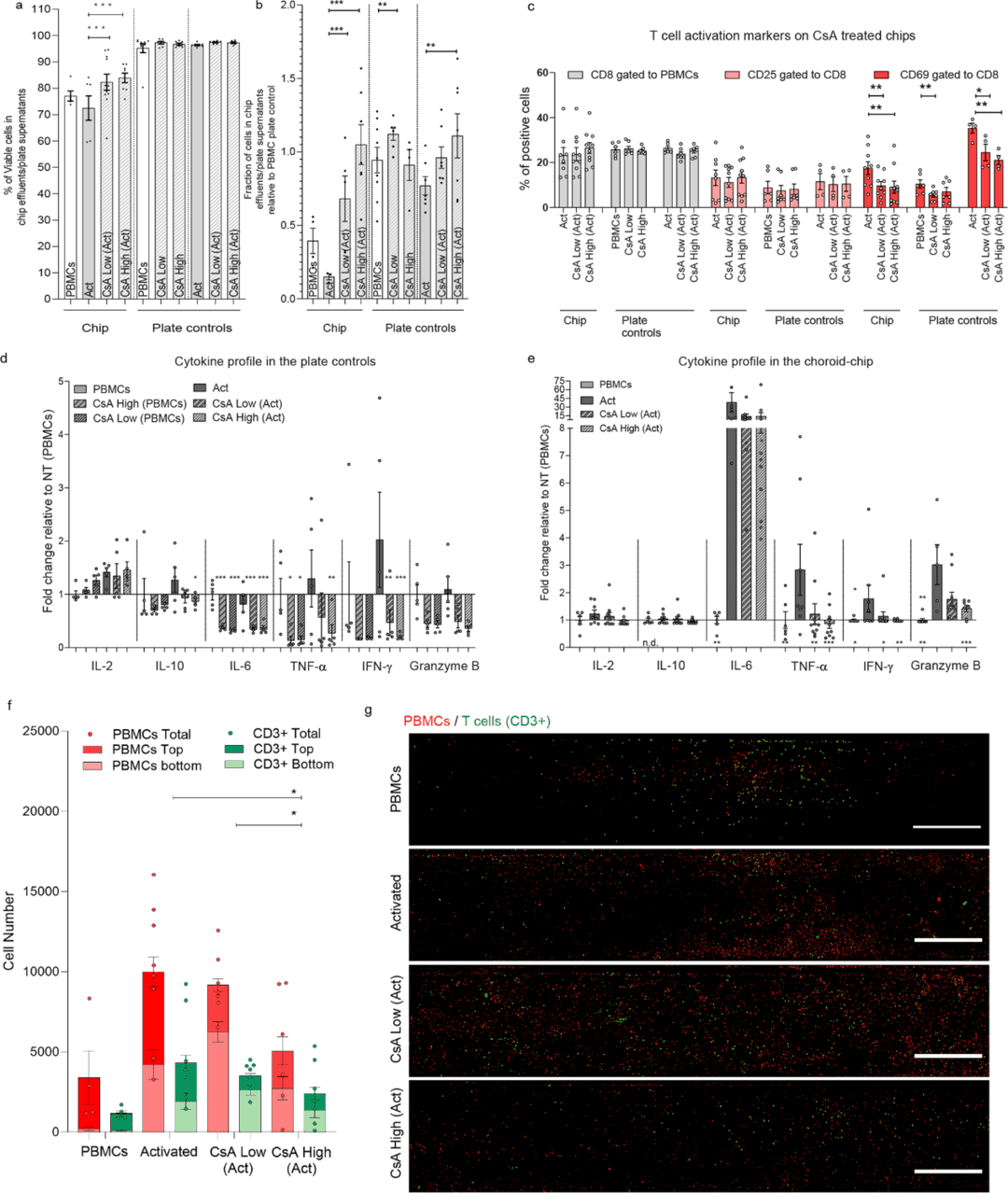 图5. 免疫抑制药物环孢素(CsA)在灌注或细胞培养 24 h 后,分别对高浓度和低浓度 CsA 处理和未处理的 PBMCs、活化PBMCs(Act)的免疫能力 CoC 的影响。
图5. 免疫抑制药物环孢素(CsA)在灌注或细胞培养 24 h 后,分别对高浓度和低浓度 CsA 处理和未处理的 PBMCs、活化PBMCs(Act)的免疫能力 CoC 的影响。
数据还显示灌注活化 T 细胞的 CoCs 中 IFN-γ 和 TNF-α 升高,这可能表明 T 细胞依赖性单核细胞活化和迁移,以 CD3 阴性 PBMCs 群为代表,高浓度的 CsA 使其减少 2 倍以上(图 5f)。在灌注了活化 T 细胞的芯片中,只有 50% 的迁移细胞是 CD3 阳性的,与它们进入黑色素细胞室的深度无关。对于灌注有 PBMCs 的芯片,大部分细胞位于隔室的上半部分,靠近内皮细胞(图 5f)。并没有被 CsA 处理逆转,这表明 CsA 处理影响了浸润黑素细胞室的细胞数量,但不影响免疫细胞类型的空间分布。
30 多年来,双特异性 T 细胞抗体桥(T cell engagers, TCBs)一直被研究用于免疫肿瘤治疗。然而,在非人类灵长类动物的毒性研究和临床研究中发现,这种作用方式仍有未解决的潜在安全风险。TCBs 是靶向 T 细胞/CD3 复合物的恒定成分和肿瘤相关抗原(tumor-associated antigen, TAA)的抗体。为了测试 CoC 在免疫安全评估方面的能力,研究测试了两种抗体,分别标记为 A 和 B,两者都含有 T 细胞受体结合域,但缺乏 TAA。两种 TCB 都与一种市售试剂进行了比较,后者通过接触含有抗 CD3/CD28 抗原的珠子来激活和扩增人类 T 细胞。PBMC 悬浮液补充有不同的 T 细胞激活剂,然后通过 CoC 灌注 24 h。在所有流出物中回收的 PBMCs 均表现出良好的活力(图 6a)。在芯片灌注后和平板对照中,用 TCB B 处理导致的细胞恢复率高于 TCB A 或激活条件(图 6b)。与商业 Act 相似,两种 TCB 均导致 IL-2 的低增长。
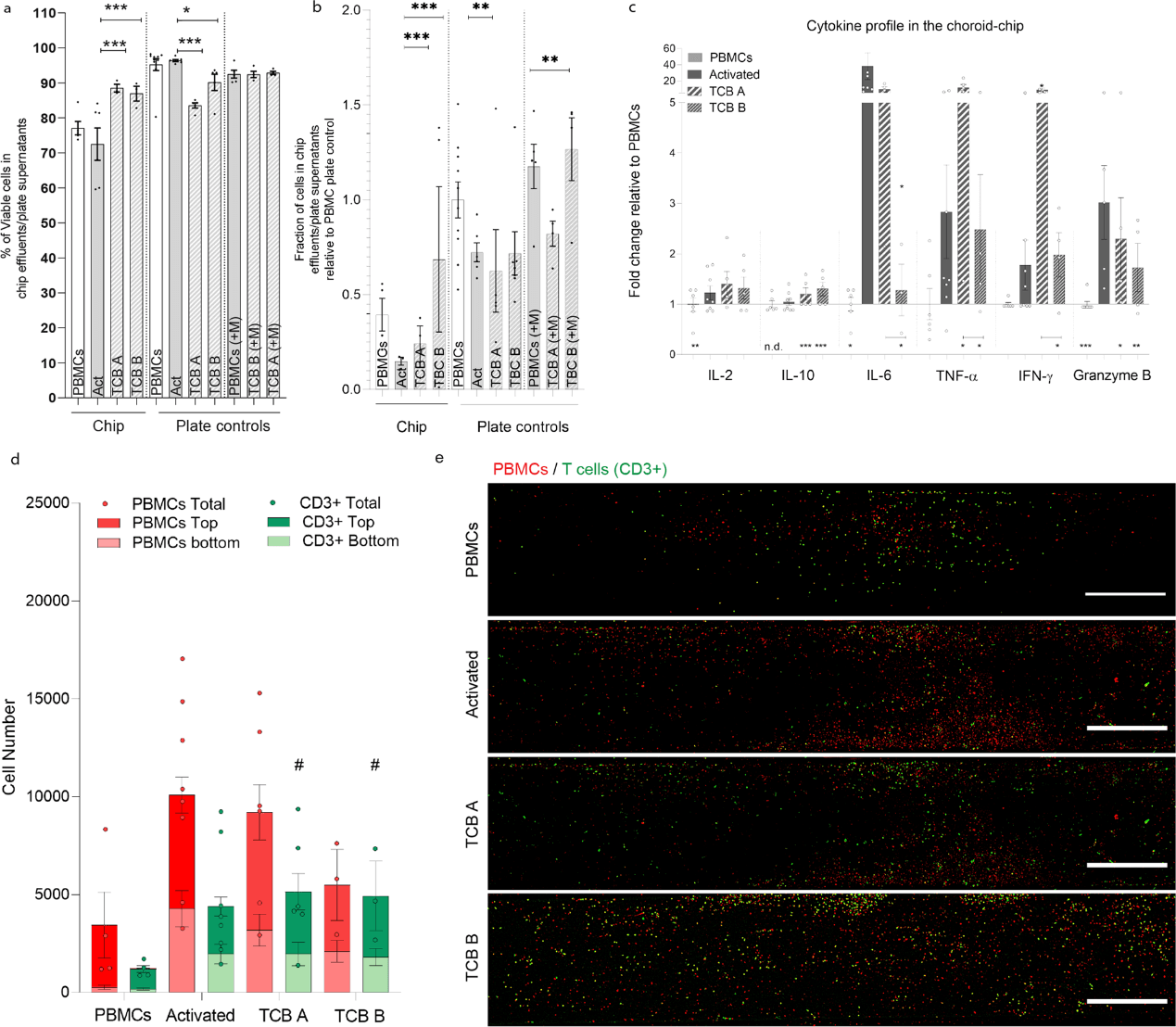 图6. 分别用 TCB A 或 TCB B 处理和未处理的 PBMC,在灌注或细胞培养 24 h 后,TCB 对黑色素细胞密度低的免疫性脉络膜芯片的影响。
图6. 分别用 TCB A 或 TCB B 处理和未处理的 PBMC,在灌注或细胞培养 24 h 后,TCB 对黑色素细胞密度低的免疫性脉络膜芯片的影响。
TCB B 引起最小的细胞因子释放,其中颗粒酶 B 有一些增加。TCB A导致 TNF-α 和 IFN-γ 的水平明显高于商业激活剂,而后者显示更高水平的 IL-10、IL-6 和颗粒酶B。这非常有趣,因为如上所述 T 细胞分泌 TNF-α 和 IFN-γ 会导致单核细胞向葡萄膜黑色素细胞迁移,这可能会导致无针对性的、不想要的和可能有害的免疫反应。数据显示,TCB B 导致 T 细胞招募到黑色素细胞区的情况与 TCB A 和激活状态相似,但 CD3 阴性细胞的募集较少。这些观察结果和 TCB B 处理的芯片流出物中更多的细胞支持其对 T 细胞特异性募集的更高效率,同时产生较低水平的促炎细胞因子。
在这项研究中,研究人员构建了一种微生理 CoC 模型,再现了人类脉络膜的主要特征,如细胞组成、色素、组织特异性内皮屏障以及细胞因子的分泌,并能够对免疫调节策略,包括免疫抑制剂和免疫激活剂做出反应。该 CoC 模型可用于探索癌症治疗的免疫相关疗法的葡萄膜炎副作用的机制,以及用于在炎症性脉络膜模型中筛选葡萄膜炎疗法。虽然没有重现全部事件,但药物诱导的葡萄膜炎的主要分子事件炎症和免疫细胞浸润到脉络膜中可以被模拟。CoC 中的免疫反应被证明对 T 细胞的激活和抑制机制很敏感,这是一个与人体相关的健康和疾病体外模型的关键方面。此外,为构建 CoC 模型而建立的过程也可能会转化为其他组织,其中基质细胞、内皮细胞和上皮细胞是疾病或毒性机制的关键因素,可扩大到测试多个供体,以探索特定病人的特异性机制研究。这可能有助于建立一个再现免疫系统各个方面的体外模型工具箱,以研究免疫肿瘤疗法,如检查点抑制剂、TCB 和 CAR-T 细胞等。
原文链接:https://www.nature.com/articles/s42003-021-02977-3
作为全球优质的临床前药物开发服务供应商,安必奇生物拥有丰富的体外模型构建、器官芯片开发等代理经验。提供优质、完善的器官芯片设计及开发服务,以帮助客户获取高仿、节能的生理学研究及药物开发工具。目前已建立能够模拟心脏、肝脏、肺、肾、脑、肠等器官的微结构和功能的芯片模型。可从材料、制备技术、仪器、以及商业化等方面实现个性化定制。欢迎免费咨询!
24小时服务在线

