1. LabonaChip:混合皮肤芯片用于化学药物和化妆品毒理学评估
2. Nature:新研究为 Omicron 免疫逃避增加了更多证据
3. 观点看法:欢迎替代动物试验
4. 观点看法:细胞和基因疗法开发的机遇和挑战
5. Telix 与 Olivia Newton-John 癌症研究所合作开展脑癌成像研究
6. FDA 批准额外的口服抗病毒药物用于治疗某些成人的 COVID-19

开发局部应用的药物和化妆品需要在皮肤模型中进行安全测试。然而,目前的皮肤模型,例如皮肤细胞片和人造组织工程皮肤,不允许进行复杂的毒理学评估(例如,感官刺激、肝毒性等),并且世界范围内禁止使用动物模型来测试化妆品。因此,急需在体外建立可靠的人类皮肤模型,再现皮肤组织的生理特征。12 月14 日,一篇发表在 Lab on a Chip 上的研究开发了一种能够对药物和化妆品化合物进行精细毒理学评估的混合人体皮肤模型。该模型通过与钙成像技术相结合,检测神经元活动的改变,实现了化学处理后的实时定量皮肤致敏分析。此外,对于皮肤-肝脏模型,将来自多能干细胞的肝细胞在远离皮肤层的 3D 胶原蛋白中培养。该模型中皮肤应用化学品时潜在的肝毒性可以通过谷胱甘肽和活性氧的量化来评估。该研究开发的 3D 混合皮肤芯片将为制药和化妆品行业提供至关重要的体外模型。
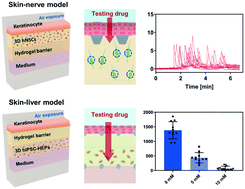
原文链接:https://pubs.rsc.org/en/content/articlelanding/2022/LC/D1LC00550B

12 月 23 日发布在 Nature 上的一项研究中,由哥伦比亚大学的研究人员与香港大学的科学家合作进行的一项新研究增加了更多的证据,表明 Omicron 变体可以逃避疫苗和自然感染所赋予的免疫保护,并认为需要开发新的疫苗和治疗方法,来预防该病毒可能很快就会发生的演变。该结果与其他中和研究以及南非和英国的早期流行病学数据相一致,这些数据显示,两剂疫苗对 omicron 变体无症状疾病的效用显著降低。此外,在这项研究中,还在 omicron 中发现了四个新的 spike 突变,这些突变有助于病毒逃避抗体。
原文链接:https://www.nature.com/articles/d41586-021-03824-5
美国参议院领导人于 10 月 7 日提出了《2021 年美国食品和药物管理局现代化法案》,以修订萧条时期要求对新药进行动物试验的法规。自 1938 年颁布以来,《联邦食品药品和化妆品法案》(Federal Food Drug and Cosmetics Act, FFDCA)要求对所有新药和疫苗进行动物试验,以获得安全和疗效数据。然而,动物试验在预测药物和疫苗对人类的安全性和有效性方面是非常差的。例如,2003 年,Elan 制药公司被迫终止了一项二期临床试验,因为发现一种研究中的阿尔茨海默氏症疫苗会导致人类脑部肿胀,虽然在转基因小鼠或非人类灵长类动物中未检测到明显的不良反应。此外,还有很多潜在的治疗方法由于不可靠的动物试验而被淘汰。总体而言,约有 90-95% 在动物试验中被发现安全有效的药物在人体临床试验中失败,主要是因为动物试验无法预测的毒性或缺乏疗效。

目前,生物打印器官模型、器官芯片模型等已经开发出来,可以更准确、更快速地预测人类对新药的反应,这些方法优势在于它们基于人类生物学。使用基于人类生物学的测试方法可以更好地预测人类在临床试验中对药物和疫苗的反应,并加快向患者提供药物的速度。认识到需要更好的人类疾病模型,美国生物医学高级研究与发展局于 9 月颁发了用于 COVID-19 人类疫苗研究的器官芯片和肺芯片的奖项。尽管有这些进步的迹象,但由于 1938 年的法律,FDA 只能继续要求研究人员在评估新药提交时依赖动物试验数据。此次的 FDA 现代化法案将使 FDA 解放出来,以便用最好的科学来解决困扰我们的疾病。

原文链接:https://www.genengnews.com/commentary/point-of-view/welcome-alternatives-to-animal-testing/
基因治疗(也称为人类基因转移)是一种将核酸作为治疗疾病的药物输送到患者细胞中的治疗方法。据 Journal of Gene Medicine 报道,截至 2018 年,全球 38 个国家已进行了超过 2,700 项基因治疗临床试验。在最近的再生医学联盟细胞和基因治疗梅萨会议上,人们注意到并讨论了弥漫性大 B 细胞淋巴瘤、急性淋巴细胞白血病、非霍奇金淋巴瘤和脊髓肌肉萎缩症患者对细胞和基因治疗的显著反应和生存率。进入细胞和基因治疗市场的公司和组织的规模和复杂程度正在逐步增长。随着各种规模的公司参与进来,希望他们能够利用其增加的广度和深度来开发新标签、新试验并找到大规模生产这些疗法的方法。

在保证细胞和基因疗法要发挥其临床潜力的情况下,可扩展性和可制造性是该行业面临的两个密切相关的挑战。对于细胞疗法,最大的变异点是患者自身的细胞。必须从制造过程中去除变量和故障模式。工艺技术的创新可以带来真正的改变。可以对生产系统进行标准化和封闭,从而减少故障模式的影响。也可以将流程小型化以提高成本效率,并可能获得更好的临床结果。
原文链接:https://www.genengnews.com/commentary/point-of-view/opportunities-and-challenges-in-cell-and-gene-therapy-development/
胶质母细胞瘤(GBM)是成人中最常见的原发性脑癌,约占脑肿瘤的 50%,而成像在 GBM 的诊断、放射治疗计划和治疗反应监测中起着关键作用。12 月 22 日,Telix 与 Olivia Newton-John 癌症研究所(ONJCRI)就脑癌成像签订了临床数据访问协议,该协议涉及一项前瞻性临床试验,研究使用 O-(2-[18F]fluoroethyl)-L-tyrosine 或 18F-FET为 GBM 瘤患者进行正电子发射断层成像(FET-PET)。这项开创性的合作研究将使用 18F-FET,这是一种新的 PET 示踪剂,可以展示肿瘤细胞是否活跃。与当前的标准成像工具磁共振成像(MRI)相比,这是一种功能更强大的成像技术,并且有可能为脑癌的管理提供强大的成像生物标志物,提高存活率。

12 月 23 日,美国食品药品监督管理局(FDA)为默克公司的莫诺匹韦(molnupiravir)颁发了紧急使用授权(EUA),用于治疗轻度至中度 COVID-19,适用于 SARS-CoV-2 病毒直接检测结果为阳性的成人,以及有进展为重度 COVID-19 的高风险,并且 FDA 授权的其他 COVID-19 治疗方案无法获得的成年人群。Molnupiravir 是一种药物,通过在 SARS-CoV-2 病毒的遗传密码中引入错误来防止病毒进一步复制,该药物只能通过处方获得,应在诊断为 COVID-19 后尽快开始使用,并在症状出现后 5 天内开始使用。Molnupiravir 未被授权用于 18 岁以下的患者,是因为 molnupiravir 可能会影响骨骼和软骨的生长。

作为全球优质的临床前药物开发服务供应商,安必奇生物拥有丰富的体外模型构建、器官芯片开发等代理经验。提供优质、完善的器官芯片设计及开发服务,以帮助客户获取高仿、节能的生理学研究及药物开发工具。目前已建立能够模拟心脏、肝脏、肺、肾、脑、肠等器官的微结构和功能的芯片模型。可从材料、制备技术、仪器、以及商业化等方面实现个性化定制。欢迎免费咨询!
24小时服务在线

