肝脏是人体最大的体内器官,在维持正常生理活动中起着主导作用,如控制血糖和氨水平,合成各种激素,解毒内源性和外源性物质等。通常,肝脏具有极强的再生能力来应对物理和化学损伤。然而,由药物和慢性疾病的不良反应引起的损伤可能会永久损害其执行生理功能的能力。在进入人体临床试验之前,新的候选药物必须在动物模型(通常是大鼠和狗)中进行安全性评估。然而,这些模型并不总是能正确预测药物在人类中的毒性,尤其是与药物诱导的肝损伤(drug-induced liver injury, DILI)相关的毒性,或者来自不同模型的结果可能不一致。这种情况导致药物在试验和临床上失败,以及药物开发的巨大成本,急需提出更好的预测替代方案。
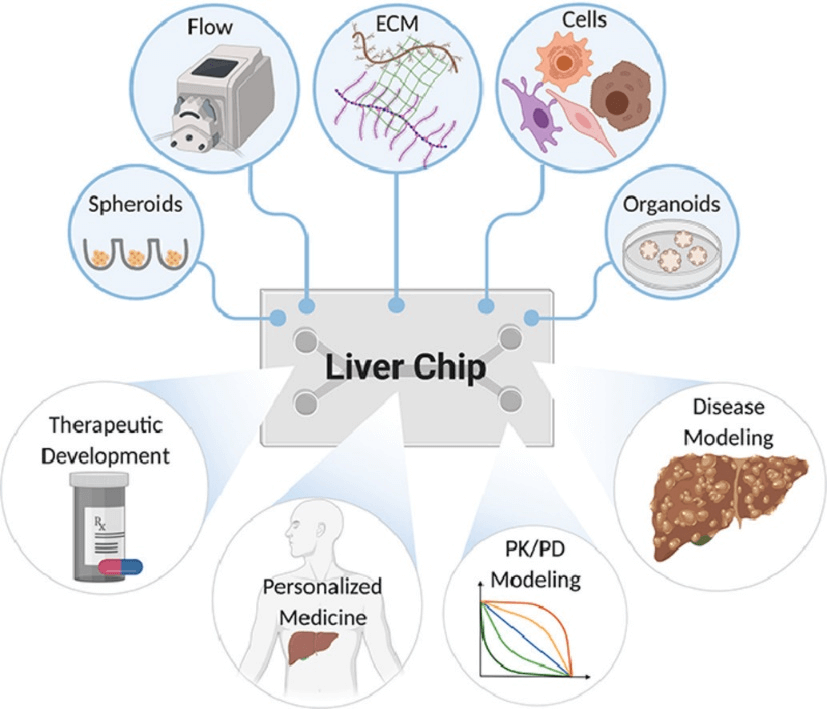
器官芯片(organ-on-a-chip, OoC)作为一种解决方案,重建了器官的 3D 微环境和功能。已成为细胞实验和药物筛选的替代候选者。肝脏芯片(Liver Chip)平台通过重现肝脏结构、保持高细胞活力和细胞表型以及模拟天然肝功能来概括人类肝脏生理学和病理学特征,因此,通常更能预测候选药物应用于人类中的结果。
 肝脏器官芯片模型示意图[1]
肝脏器官芯片模型示意图[1]
(1)原代肝细胞
优点:可包含肝脏内在特征,包括 I 相和 II 相代谢酶活性、糖代谢、氨解毒等。
局限性:失去肝脏特定功能,不适合长期使用;成本高;存在供体差异性;难以分离。
(2)肝源性细胞系
优点:无限寿命;易于操作;表型稳定;对药物代谢和毒性反应至关重要。
局限性:药物反应不准确;代谢能力低,肝脏特异性酶/转运体的表达迅速丧失。
(3)干细胞诱导肝细胞
优点:稳定的肝细胞来源;肝脏类器官;功能稳定,包括白蛋白分泌、肝脏特异性基因表达、尿素产生和代谢活性。
局限性:操作难度较大;需要特定诱导因子;成本高;不够成熟。
2D 平面培养在药物筛选的早期阶段被广泛使用,其易于处理,并且适合在短时间内筛选大量的化合物。然而,越来越多的证据表明,肝细胞的 2D 平面培养会导致肝脏标志物的表达和表型在数小时内迅速丧失,不适合长期培养,而且肝细胞和非肝细胞之间的相互作用很弱。为了模拟肝脏每种细胞类型相互作用的复杂性,研究人员开发了在 2D 基质上将肝细胞与其他细胞类型图案化和共培养的方法。微图案化的基质不仅以可控的方式改变不同类型细胞的分布,而且还为实质细胞和非实质细胞提供合适的生化线索。研究人员发现 2D 材料的表面特征,如硬度和亲水性,也会影响肝细胞的表型和功能。因此,开发合适的材料已成为 2D 平面培养的发展方向。
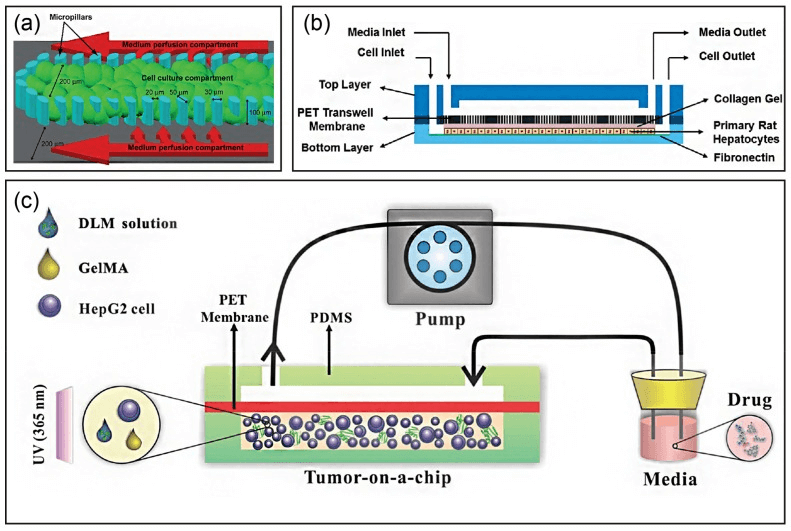
在肝组织工程中,需要一种类似细胞外基质(extracellular matrix, ECM)的支架来促进细胞粘附、支持细胞生长并增强细胞-基质相互作用。因此,各种 ECM 成分(天然和合成)已应用于肝芯片,以改善肝脏功能,用于药物和细胞毒性研究。研究人员在肝脏芯片中使用 ECM 来维持和模拟原生微环境。尽管水凝胶支架类具有似于 ECM 的结构和机械特性,但人工 3D 系统仍然缺乏促进细胞生长和维持细胞功能的适当天然生长因子。因此,脱细胞肝基质(decellularized liver matrix, DLM)成为了工程类天然肝组织的最有希望的候选者。有研究在一个微流控 3D 动态细胞培养系统中用 DLM 和明胶(gelatin metharcyloyl, GelMA)开发了一个仿生 3D 肝脏肿瘤芯片,更好地再现了肿瘤微环境,如基本的支架蛋白、生长因子、硬度和剪切应力(下图c)[2]。
 在基质依赖性 3D 培养中构建肝脏芯片的策略[3]
在基质依赖性 3D 培养中构建肝脏芯片的策略[3]
将肝细胞聚集成 3D 球状体是另一种常规方法,也是肝脏代谢和细胞毒性研究的有前途的体外模型。无基质 3D 球状体培养的方法诸如悬滴技术法、细胞排斥板法、微孔阵列法等等。悬滴技术法促进细胞聚集,从而产生球体,使用悬挂式水凝胶滴剂形成原代人类肝脏微组织可维持超过 9 天[4]。细胞排斥板方法通常用于自组装肝细胞球状体。研究人员使用磁性纳米粒子修饰原代人肝细胞,然后施加磁力以快速组装并轻松获得球状体。此外,在毒理学应用中,通过将微传感器与肝脏芯片集成,无需显微镜即可监测单个球状体的代谢参数和细胞活力。也可以应用微孔阵列以高通量和可控的方式生成 3D 球状体,球体的大小取决于微孔的大小。
肝脏中包含很多功能性重复微血管单元,具有独特的结构特征。这种分层结构允许通过逐层沉积的方式来构建肝脏芯片。例如,有研究设计了一种逐层沉积方法,将肝细胞、内皮细胞和星状细胞依次接种在中空纤维膜上。细胞附着在纤维表面,自我组装,并在纤维周围和之间形成组织状结构,并且在 28 天内合成白蛋白和尿素[5]。由于微加工和微流控技术的灵活性,多通道微流控芯片已成为重现肝脏关键组织特征的有前途的平台。例如,将负载肝源性细胞系 HepG2 细胞和人脐静脉内皮细胞 HUVEC 的胶原蛋白同步注入微流控芯片,然后利用层流的优势,两层胶原蛋白会形成清晰的界线,通过控制细胞密度和注射生长因子,胶原蛋白中的 HUVECs 可自组装成单层。
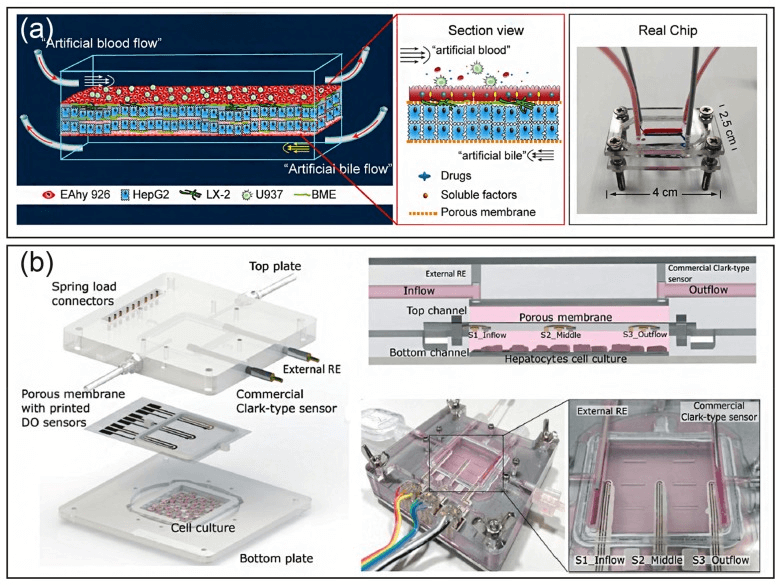 使用逐层沉积技术建立的肝脏芯片[3]
使用逐层沉积技术建立的肝脏芯片[3]
3D 生物打印主要是利用细胞、生物激素、生长因子、细胞间质等物质,打印出具有生物功能的活组织。3D 生物打印可以产生解剖学上准确的肝脏结构,包括肝脏的特定空间结构和血管网络。3D 生物打印技术的独特之处使其成为制造体外肝脏模型的越来越受欢迎的工具。例如,研究人员利用生物打印技术制造了包含原代肝细胞、肝星状细胞和内皮细胞的人类肝脏模型,用于模拟甲氨蝶呤和硫代乙酰胺诱导的肝脏损伤导致的纤维化。该模型在接触这些化合物后,检测到了肝脏损伤,包括肝细胞损伤,以及纤维状胶原蛋白的沉积和积累,这表明 3D 生物打印的肝脏再现了化合物诱导的肝脏损伤反应[6]。然而,在传统平板或 transwell 中打印的 3D 肝脏类似物无法提供动态灌注条件。因此,将生物打印的肝脏进一步与微流体和灌注装置相结合,形成肝脏芯片,可进一步增强肝脏功能。
药物引起的肝损伤仍然是造成限制性药物标签和治疗药物上市后撤回的一个重要原因。肝脏器官芯片能够模拟体内生理参数,以评估细胞对药物的行为反应,这为动物实验提供了一种替代方法。例如,研究人员设计了一种 3D 球体培养的灌注培养箱肝芯片,该芯片可保持细胞活力超过 24 天。接着,通过该装置成功评估了反复给药双氯芬酸和对乙酰氨基酚的慢性药物反应[7]。
建立肝脏芯片的目标之一是在体外建立与体内一致的肝细胞微环境。与 2D 细胞培养相比,器官芯片上培养的肝细胞的综合代谢能力大大增强。此外,与静态培养相比,肝脏芯片为肝细胞提供了动态流动环境,可使其进行更高的白蛋白合成和尿素排泄。肝脏的另一个重要功能是参与药物代谢。肝脏器官芯片可用于评估肝脏中的 I 期和 II 期代谢,并通过在肝脏芯片的前端整合一个类似肠道的结构来研究药物的首过代谢[8]。
基于器官芯片可以控制细胞外部微环境的特性,可建立一系列肝脏疾病模型,包括酒精性肝病、脂肪肝、肝纤维化、急性肝损伤和患者特异性肝病等。例如,在 Lee 的研究中,将大鼠原代肝细胞和 HSC 在流体活性芯片中共培养以观察结构变化,随着乙醇浓度的增加,肝功能逐渐下降[9]。此外,肝脏芯片装置也被用于研究宿主/病原体的相互作用。有研究构建了一个 3D 微流控肝培养系统,为乙型肝炎病毒(hepatitis B virus, HBV)研究提供了一个有价值的临床前平台,该平台能够再现 HBV 生命周期的所有步骤,包括患者来源 HBV 的复制和 HBV cccDNA 的维持[10]。在这些例子中,肝脏芯片提供了先进的疾病建模,可以更好地保留肝脏表型,对促进精准医学、靶向药物的开发至关重要。
除肝脏外,包括药物肝毒性代谢在内的生理过程也与其他器官有关。因此,器官芯片还应考虑到多个器官之间的相互作用,以研究疾病和药物筛选中的复杂机制。目前已经建立了一系列多器官芯片来模拟多器官的生理环境系统,如肠道与肝脏,肺与肝脏,甚至肠道、肝脏、皮肤、肾脏四器官联合芯片等(下图)。例如,为了评估纳米颗粒与人体组织的相互作用,通过将肠道上皮细胞(Caco-2)与粘蛋白分泌细胞(TH29-MTX)和 HepG2/C3A 细胞共培养,构建了一个胃肠道和肝脏组织系统。高剂量的纳米颗粒诱导天冬氨酸转氨酶释放,表明肝细胞损伤。因此,该装置在体外成功模拟了体内对乙酰氨基酚的摄取、代谢和毒性[11]。
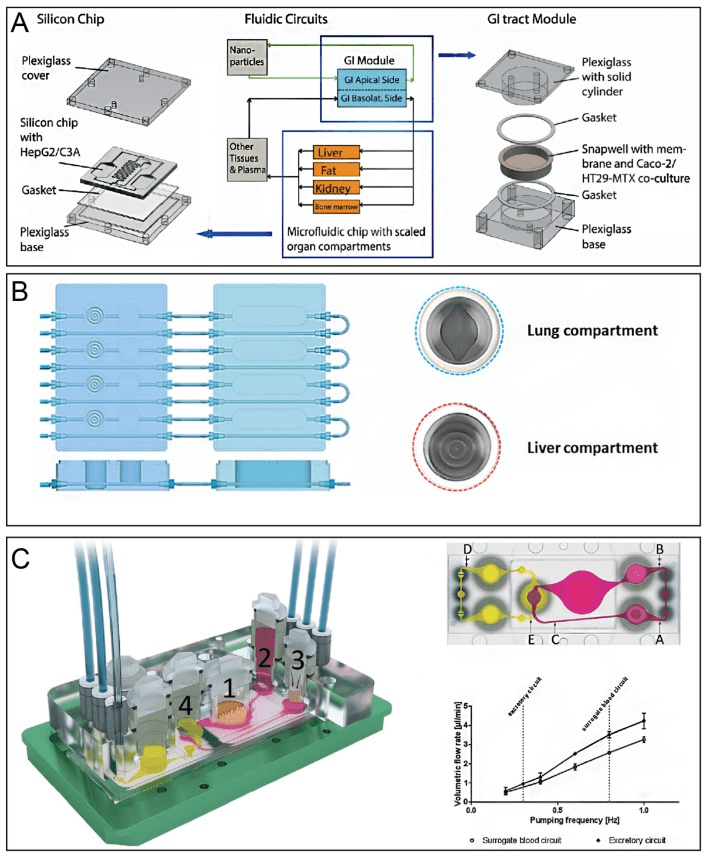 各类多器官芯片系统示意图[3]
各类多器官芯片系统示意图[3]
参考文献
作为全球优质的器官芯片模型开发服务供应商,安必奇拥有丰富的体外模型构建、器官芯片开发等代理经验。我们的肝脏器官芯片模型基于微流控技术,具有微环境可控、测量信息丰富、成本低、自动化和高通量等许多优点。此外,目前已整合了全套的器官芯片构建、体外筛选技术一站式服务,致力于为国内外药物开发企业及机构的创新药物筛选提供高效的服务和解决方案。欢迎免费咨询!
24小时服务在线

