在几乎所有的生命形式中,都存在复杂的三维(3D)结构,例如用于结构支持和运动的细胞骨架,以及完整的生物体。其中,血管系统尤其令人感兴趣,在这里,复杂的、分层的、分支的 3D 结构通过泵送流体流动和扩散过程的组合,将基本的水和生物化学物种输送到活体组织中。在脊椎动物中,血管和心脏一起构成了一个封闭的血管系统。动脉将血液带离心脏。小动脉从动脉分支出来,连接到毛细血管网络,支持血液和周围组织之间的水、营养物质、氧气和细胞废物的交换。小静脉收集来自毛细血管的血液,并通过静脉将血液带回心脏。
创新的人工血管系统将为体外血流动力学和疾病的基础研究平台提供更多可能性。人工血管网络方面研究的一个关键挑战是开发快速、通用的方法来制造具有必要几何形状和特征尺寸的 3D 微流体网络。现有的制造 3D 微流体结构的方案在实现所需的布局设计、生产生理上相关的微血管结构和集成有源电子/光电/微机电元件以进行传感和驱动方面受到限制。一些通用的方法涉及 3D 打印技术,但分辨率的限制阻止了内径小于 50 μm 的封闭通道的常规构建,有限的材料选择也限制了某些类型的结构部件和功能元件的构建。因此,急需可行的补充替代方案,提供高分辨率特征、大面积覆盖、多样化几何布局的能力。

2021 年 11月 20 日,西北大学的研究人员在 Scientific Advances 杂志上发表了题为“由机械引导压缩屈曲形成的复杂 3D 微流体架构”的研究论文。该研究提出了一种机械引导组装方法,利用 2D 制造方法的完整复杂性从 2D 前体生成复杂的 3D 微血管结构。可在一个并行的、高通量的过程中,在广泛的整体尺寸范围内(功能特征尺寸扩展到 < 5 μm)扩展阵列和各种嵌入式传感器和执行器。可确定地设计和建造具有复杂布局的 3D 微血管网络,以扩大人工血管网络的几何形状和操作特征。

整体构建流程如图 1 所示,首先利用软光刻制备 2D 微流体前体,随后通过压缩屈曲将它们转换为 3D 微血管系统。该系统结构是双层 3D 架构,其几何特征与基本生物血管网络相当(图 1A,1B)。具体来说,布局涉及微通道阵列宽度的逐步变化(从 100 μm 到 30 μm 和 10 μm,然后回到 30 μm 和 100 μm)和三级分支配置(图 1C),用以模拟动脉、小动脉、毛细血管、小静脉和静脉的集合。较窄的通道宽度为 10 μm,与人体毛细血管的大小相当。整体 3D 形状近似于一个球体,在顶层和底层之间有一个封闭的内腔,类似于肾小球和肺泡等生物结构。
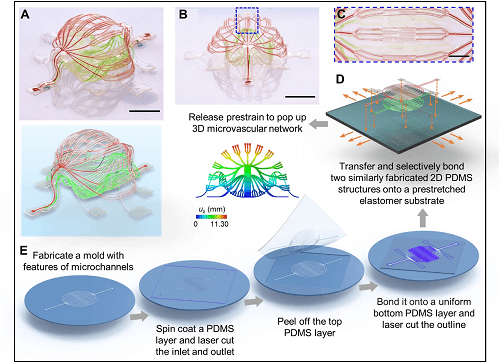 图1. 通过机械引导组装形成的 3D 微血管系统的示意图。
图1. 通过机械引导组装形成的 3D 微血管系统的示意图。
该构建体的制造过程是首先在 PDMS 中形成 2D 微流体系统(图 1E)。通过在模具上浇铸和固化一层这种材料,激光切割制造出用于流体引入和移除的入口和出口。接着将该 PDMS 结构从模具上剥离下来,并将其粘合到一个平坦的 PDMS 层上,该层在未图案化的硅晶片上浇铸和固化,从而形成密封的 2D 微通道网络。另一个激光切割过程产生了一个遵循微流体通道几何形状的开放式 2D 架构。从晶圆上剥离该系统(即 2D 前体),将其粘合在预拉伸弹性体基板上的选定位置(如图 1 中橙色点位置),然后释放此预拉伸会产生作用在粘合位置的压迫力,触发屈曲过程,将相关的几何形状转换为 3D 布局。相同的过程可以应用于广泛类别的材料,不仅包括用于微流体系统的材料,还包括用于电子和光子功能的材料。在这些简单的程序的基础上,具有复杂性和多功能集成的 3D 微通道几何形状很容易获得。
使用这些策略可以实现多样化的 3D 微流体系统集合,包括细丝和膜型架构(图 2A,2B)。在这些情况下,有限元分析(finite element analysis, FEA)可作为一种方便、严格的方法来预测这些 3D 微血管系统所有部分的几何形状和应变分布。如图 2 所示,FEA 结果与实验结果很一致。除了整体几何形状外,FEA 模拟(图 2C)还可以指导避免微通道机械坍塌的设计。微通道的宽高纵横比严重影响其在 3D 组装过程中的变形。图 2C 显示,当纵横比超过 6 时,由于与 3D 转换过程相关的变形,通道高度在某些位置(例如靠近接合点或在中跨处)会降低到其原始值的一半以下。对于具有给定宽度的微通道,总结构宽度(由 PDMS 侧壁的厚度决定)对微通道的变形几乎没有影响。
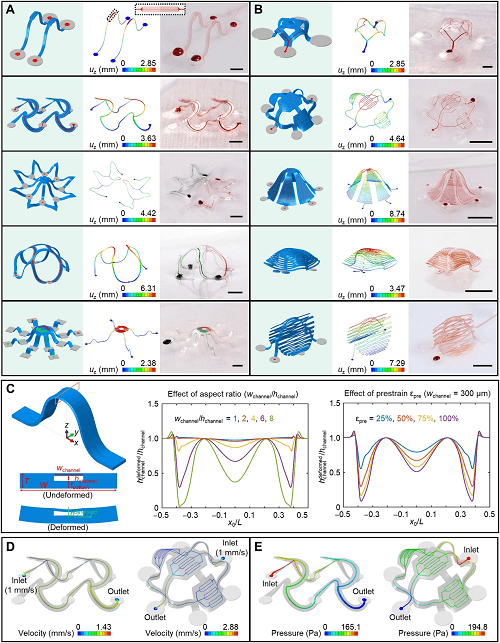 图2. 通过机械引导组装形成的各种 3D 微血管结构。
图2. 通过机械引导组装形成的各种 3D 微血管结构。
计算技术还可以揭示通过这些 3D 系统的流体动力学。图 2D 和 2E 显示了流速和压力差等特性的数值结果。由于内表面的无滑移边界条件,通道中心的速度较高。分支点前后的总流量保持不变,体现了质量守恒。在双层螺旋微血管网络(图 2D 左)中,两个分支的横截面积等于主微通道横截面积的一半,因此峰值流速沿微通道保持不变。在简化的类血管系统网络中(图 2D 右),在三级分支结构之后,流速显著降低,与人体毛细血管中的性质相似。在图 2E 中,压力从入口到出口逐渐减小,符合 Hagen-Poiseuille 定律的阻力。
作为图 2 中示例的高级版本,复杂的、扩展的和多层的几何形状也是可能的,都由 FEA 建模指导(图 3)。如图 3A 所示,可包括三个 3D 微血管结构的并排阵列和不同尺寸的多层结构阵列。在该示例中图 3B 右下演示了通过高分辨率激光切割形成窄丝状元件的能力,图 3C 显示了使用图中所示的 2D 前体形成的两个相互连接的 3D 微流体网络。在所有示例中,实验结果与 FEA 预测非常吻合。证明 FEA 方法可加速迭代设计工作并提供有关局部和全局变形的详细信息。
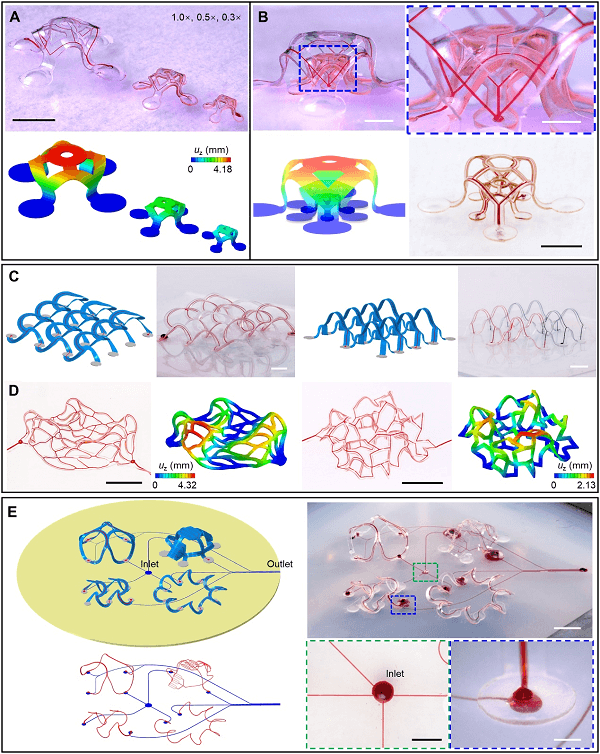 图3. 3D 微血管网络阵列。
图3. 3D 微血管网络阵列。
此外,不规则的 3D 微流体结构完全可以通过相应的 2D 形状的压缩屈曲来实现。图 3D 展示了代表性的设计,其中不规则的 2D 几何形状类似于简化毛细管网络的模拟,可以确定性地转化为不规则的 3D 架构,有多个随机分配的结合点(图 3D 左)。更为普遍的是,不规则的 3D 结构可以在压缩屈曲中遵循相同的设计规则来实现例如,图 3D 右图中的随机 3D 网络。在弹性体基底中引入 2D 微流体通道和网络,连接到支持的 3D 微流体结构中的通道和网络,在组装方案中产生一个完整、可处理的网络(图3E),这种可拉伸的流体互连系统可用于同时处理多个 3D 微流体结构。
图4(A至D)是两个 3D 人工微血管网络,每个网络的特征都与动脉、小动脉、毛细血管、小静脉和静脉的生物血管网络相当。其中一种设计由延伸和分布的 3D 细丝组成(图 4A,4B),另一种设计包含近乎直立几何形状的 3D 细丝(图 4C),两者均使用相同类型的 2D 微流体前体形成,只在结合点的形状和大小上有所不同。这些 3D 微血管网络除了在几何形状和特征尺寸上,在功能上也可以采用仿生设计。例如,使用可渗透/多孔的软材料(标准 PDMS 和多孔 PDMS)作为通道可以产生所需的运输性能,与周围环境进行化学交换。图 4E 展示了氧气通过这种 3D 微流控通道输送到氧敏水凝胶块中。氧气的扩散会触发化学反应,将水凝胶块中的无色亚甲蓝(LMB)转化为亚甲蓝,相应地从无色变为蓝色。计算建模可以捕捉扩散过程的物理特性和相关的氧浓度分布(图 4E,右一)。此外,图 4F 展示了牛血清白蛋白(BSA)通过具有多孔顶层的 3D 微流体通道的扩散运输。与 BSA 结合的荧光分子可以使扩散过程可视化。二氧化碳和废物可以通过 3D 微流体通道收集和运输,使用这种策略,具有用于组织培养平台、人造器官、生物机器人等的潜力。
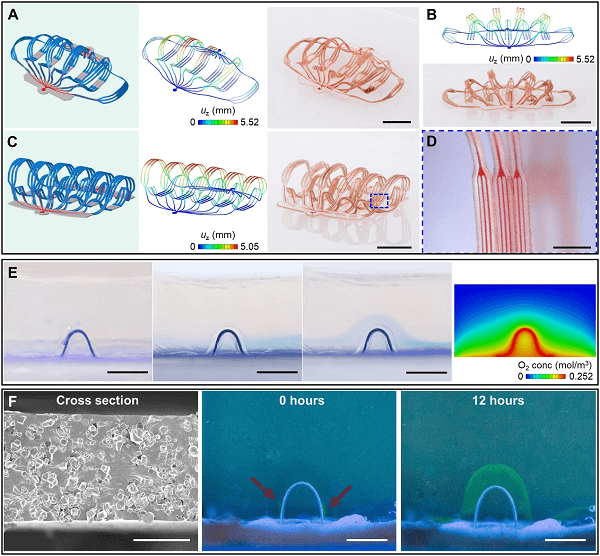 图4. 人工微血管网络的表征。
图4. 人工微血管网络的表征。
用于温度和化学传感、热驱动、射频通信等的电子/光电设备的集成在 3D 微流体系统中创造了广泛的研究机会。图 5 所示的代表性 3D 混合微流体和电子系统采用互连的 4×4 双层螺旋阵列微血管网络的形式,带有电子接口。在压缩屈曲下,微流体前体和导电网一起变形以产生 3D 双层螺旋几何形状(图 5A,5B)。实验结果与 FEA 预测匹配良好。如图 5C 所示,整个系统的力学原理允许弯曲、扭曲和其他类型的变形。这种结构支持 16 组电子元件(图5D)。每组包括一个微型无机发光二极管(μ-ILED;图 5D,中间)和一个热致动器或一个热敏电阻(图 5D 右图中的微型电阻器)。这样,该系统不仅提供了流体运输的能力,而且还提供了电、光、热驱动和热感应的能力。综上,将高性能的电子元件集成到复杂的 3D 微流体结构上,可以形成完整的、系统的微血管网络,同时具有流体运输和电子感应及调节能力。
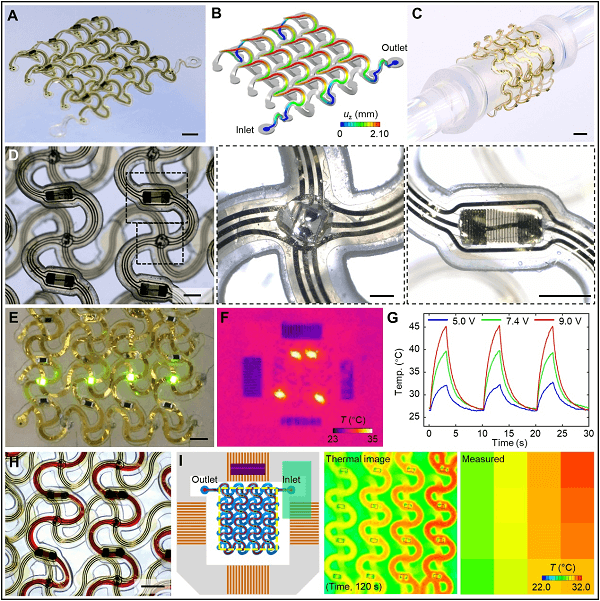 图5. 具有电子接口的 3D 微血管网络的扩展、互连 4×4 双层螺旋阵列形式的 3D 混合微流体和电子系统。
图5. 具有电子接口的 3D 微血管网络的扩展、互连 4×4 双层螺旋阵列形式的 3D 混合微流体和电子系统。
该研究建立了一种通用且稳健的方案,用于以并行、高通量的方式在广泛的整体尺寸中形成复杂的 3D 微流体结构和扩展的 3D 微血管网络。这种方法的关键独特方面是获得了微米级的通道尺寸(例如 4 μm)和集成的功能部件。通过嵌入支撑基质中的通道将液体输送到 3D 网络中,以及允许一些分子穿过微通道结构壁,代表了这些构造在 3D 组织培养、生化分析系统、微反应器等方面的潜在用途。然而,在人工微流控结构中重现真实生物系统非常复杂、分层的 3D 几何结构仍然具有挑战性。而且,要将液体均匀地输送到 3D 微通道周围或优先输送到一个局部区域,需要采用其他方法。这些机遇和挑战也是未来工作的焦点方向。
原文链接:https://www.science.org/doi/10.1126/sciadv.abj3686
作为全球高品质临床前药物开发服务供应商,安必奇生物拥有丰富的体外模型构建、微流控器官芯片开发等代理经验。提供优良、完善的器官芯片设计及开发服务,以帮助客户获取高仿、节能的生理学研究及药物开发工具。目前已建立能够模拟心脏、肝脏、肺、肾、脑、血管等器官的微结构和功能的芯片模型。可从材料、制备技术、仪器、以及商业化等方面实现个性化定制。欢迎免费咨询!
24小时服务在线

