脾脏位于腹腔的左上方,是一种次级淋巴器官,也是参与细胞和体液免疫的血液过滤器官,可清除循环中的衰老和不易变形的红血球(red blood cells, RBCs)。此外,在循环红细胞通过脾索中的内皮间裂隙(interendothelial slits, IES)期间,脾脏还会从循环红细胞中剔除细菌和其他病原体,包括疟原虫。实现脾脏血液过滤功能的能力归功于精致的组织分隔及其独特的循环系统。
由于伦理和技术原因,脾脏的功能研究依赖于动物模型。器官芯片微流控设备的开发和验证,加速了生理和药物发现,减少了对动物实验的依赖,为研究脾脏的功能提供了一个强有力的替代方案。先前已构建两种不同的微流控装置,模拟了脾脏的快流和慢流区间以及 IES,并显示可保留来自遗传性球形红细胞增多症的寄生、老化或缺陷的红细胞。然而,这两项研究都没有报告对剔除寄生虫的观察。
2021 年 11月 11日,巴塞罗那大学的研究人员在 Scientific Reports 杂志上发表了题“模拟脾脏内皮间裂隙的微流体装置中疟原虫的剔除”的研究论文。该研究开发了两个模拟 IES 的微流控装置,并假设红细胞在一定范围的机械应力下,通过狭缝大小和血流进行调节,将迫使其经历剔除过程而不影响细胞完整性。结果表明,两种微流控设备模型都能够在体外通过机械约束重现恶性疟原虫感染的红细胞(P. falciparum-infected RBCs, P.f.-RBCs)的剔除,而没有细胞的参与,这对脾脏在疟疾病理生理学中的作用提供了新的见解。

基于增加 IES 数量以实现 RBC 通过这些狭缝的统计显著性的原则,设计并构建了如图 1A 所示的两种不同的模型。其中,模型 1 由尺寸为 50 µm × 50 µm 的固定柱组成,狭缝宽度从 50 到 2 µm 不等,总共有 120 个狭缝。柱子的大尺寸使细胞通过狭缝所需的时间增加,使得受感染的细胞更长时间地暴露于变形应力以发生剔除。模型 2 由 100 µm × 100 µm 到 10 µm × 10 µm 的不同尺寸的柱子组成,狭缝宽度从 100 µm 减小到 2 µm。这种小柱尺寸的优势是增加了每个芯片的狭缝数量,总共 498 个,因此其性能依赖于高频的剔除。
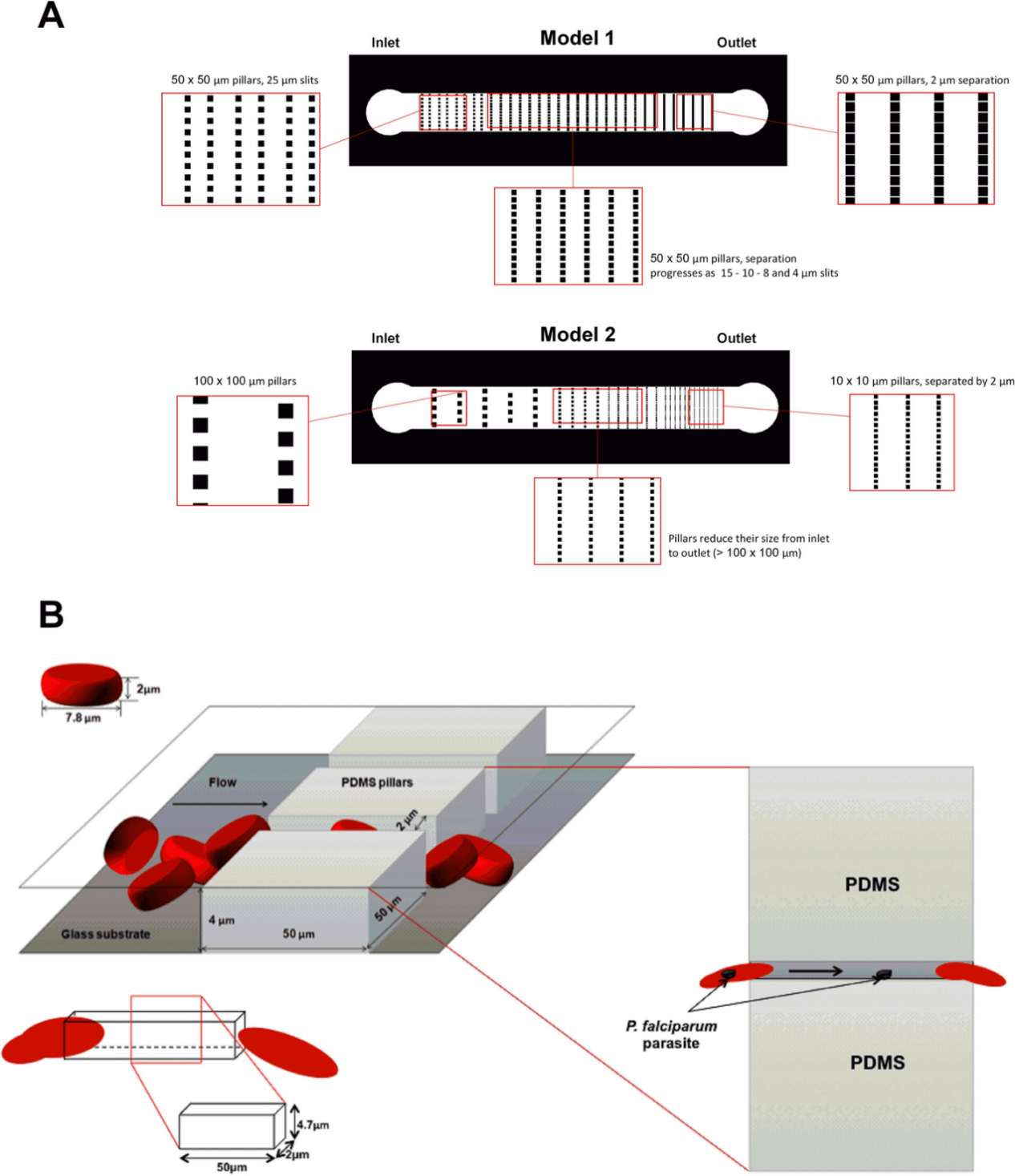 图1.用于剔除研究的微流体装置设计。
图1.用于剔除研究的微流体装置设计。
为避免细胞旋转,微通道的高度不应超过细胞的直径。考虑到红细胞的平均大小(直径 7.8 µm ,高度 2 µm),研究人员为微通道定义了两个高度。狭缝横截面大约比细胞面积小 5.75 和 3.41 倍(图1B)。这些柱子旨在阻碍细胞的流动,以减少 RBCs 的数量,并在的狭缝区以较小的浓度观察它们。设计的微通道狭缝区域将模拟脾脏的 IES,负责其过滤功能。
根据前面的设计以高分辨率打印在直径为 10 cm 的铬玻璃掩模上。该微通道的制造使用了光刻和复制成型技术(图2)。母版是在硅基板上旋涂 SU-8 阴性光刻胶制造的。在硅片被光刻胶完全覆盖后,将具有所需图案的铬光掩模放置在新涂层材料上,激活受控的紫外光源,导致负性光刻胶聚合固化。由于 SU-8 是一种阴性光刻胶,被掩膜覆盖的路径不受紫外光的影响。固化完成后,用 SU-8 显影剂来清硅片,未固化的聚合物被剥离,只留下由掩膜印刷的图案。光刻工艺后,在硅表面上进行硅烷化工艺以创建保护表面的单层,防止 SU-8 结构分离。接着,将得到的硅片用 PDMS 覆盖,并在 65℃ 下固化 2 h,再小心地将其从硅片上剥离,使用锋利的刀片切割出通道。用水和乙醇清洗后,再用异丙醇和去离子水对其进行冲洗。结束后,使用氧等离子体将 PDMS 通道粘合到干净的玻璃基板上,获得微器件。
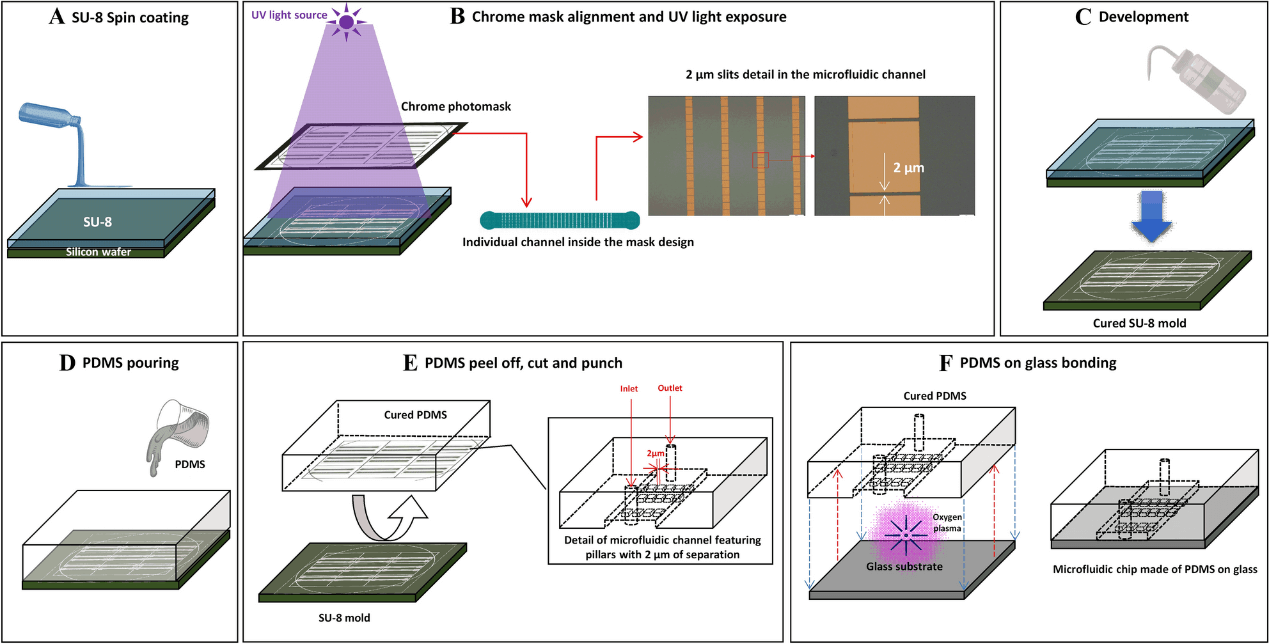 图2. 微流体设备制造的工作流程。
图2. 微流体设备制造的工作流程。
由充满血液的 1 ml 注射器组成的系统通过带有 Tygon 管的针头连接到微流体装置(输入),微通道的输出通过 Tygon 管连接到容器,以收集通过微装置的血液。注射器由 KDS 200 系列泵驱动(图3A,3B)。在微流体装置中建立了 5 μl/min 的恒定流量。在所有情况下,血液仅通过设备一次。实验在室温下进行。连接到倒置显微镜的 Optikam 相机被用于记录图像(图3B)。
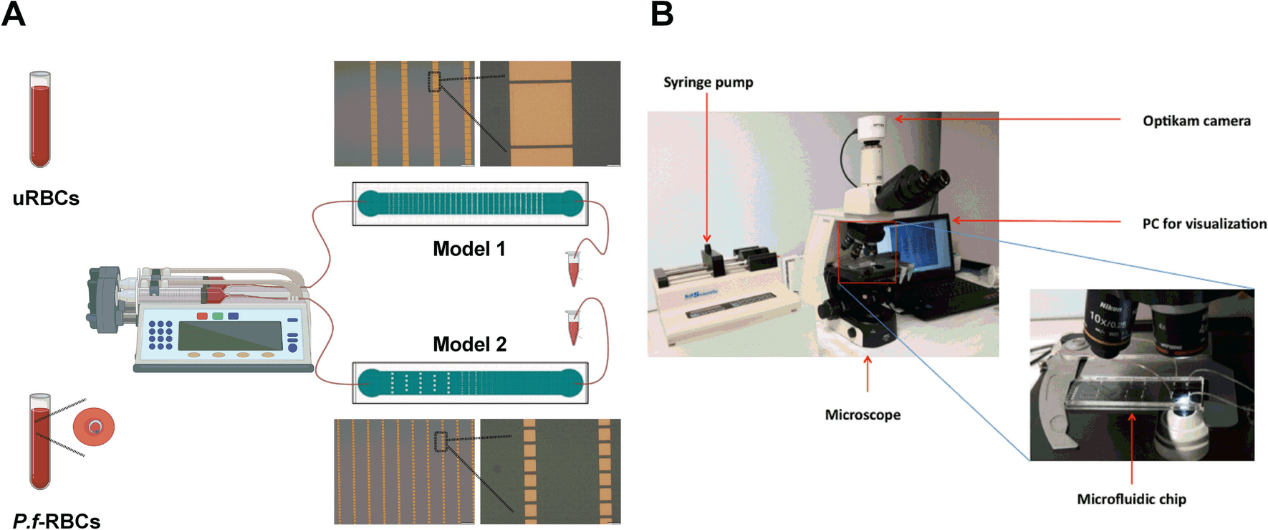 图3. 在 VECT 上保留细胞功能。
图3. 在 VECT 上保留细胞功能。
进行溶血实验是为了排除流经微通道的流量导致红细胞在通过狭缝时破裂的可能性。为此,对细胞培养基中释放的血红蛋白进行了分光光度定量。目测(图4A)和通过分光光度法定量的统计分析(图4B)表明,非感染和 P.f.-RBCs 通过两种设备模型后是完整的。重要的是,没有检测到以生理流速(5 µl/min)或 40 倍生理流速通过设备的红细胞溶血。这些数据表明,红细胞通过设计的两种微流体装置的狭缝后仍保持完整。
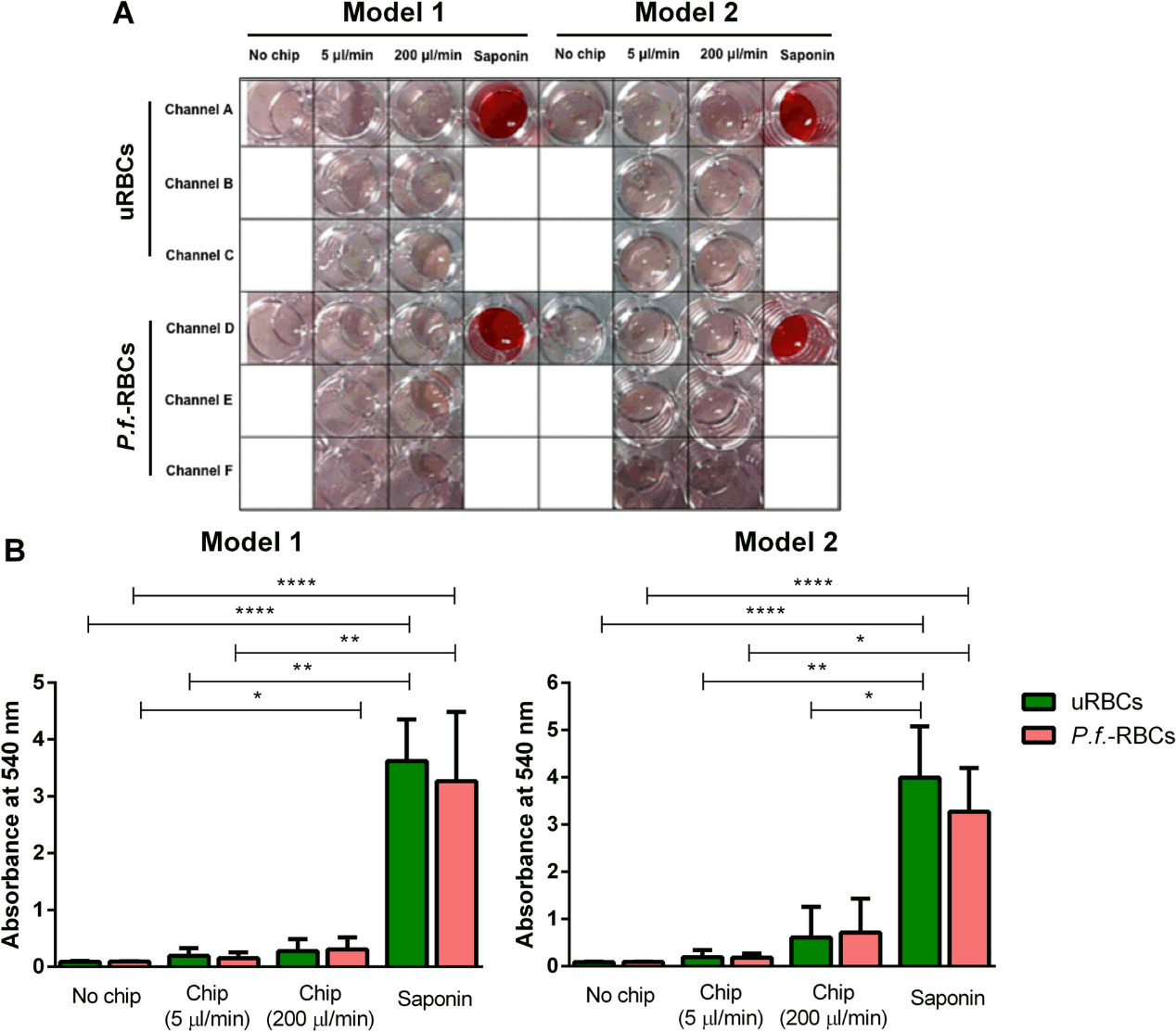 图4. 红细胞通过微型装置后的溶血定量。
图4. 红细胞通过微型装置后的溶血定量。
RESA 抗体可与暴露在受感染的 RBC 表面的 RESA 蛋白结合,DAPI 可染色寄生虫的 DNA,因此预计含有完整寄生虫的 P.f.-RBCs 会被双染色。相比之下,被剔除寄生虫的红细胞(once-infected RBCs, O-iRBCs)预计会失去寄生虫 DNA 染色,同时将 RESA 保留在其表面。在红细胞通过微流体装置后,通过荧光显微镜检查感染细胞中的这些标记物的染色情况,结果证实了预期的染色模式(图5)。表明恶性疟原虫感染的红细胞通过微型装置狭缝导致寄生虫的丢失,从理论上支持这些装置对脾脏剔除功能建模的适用性。
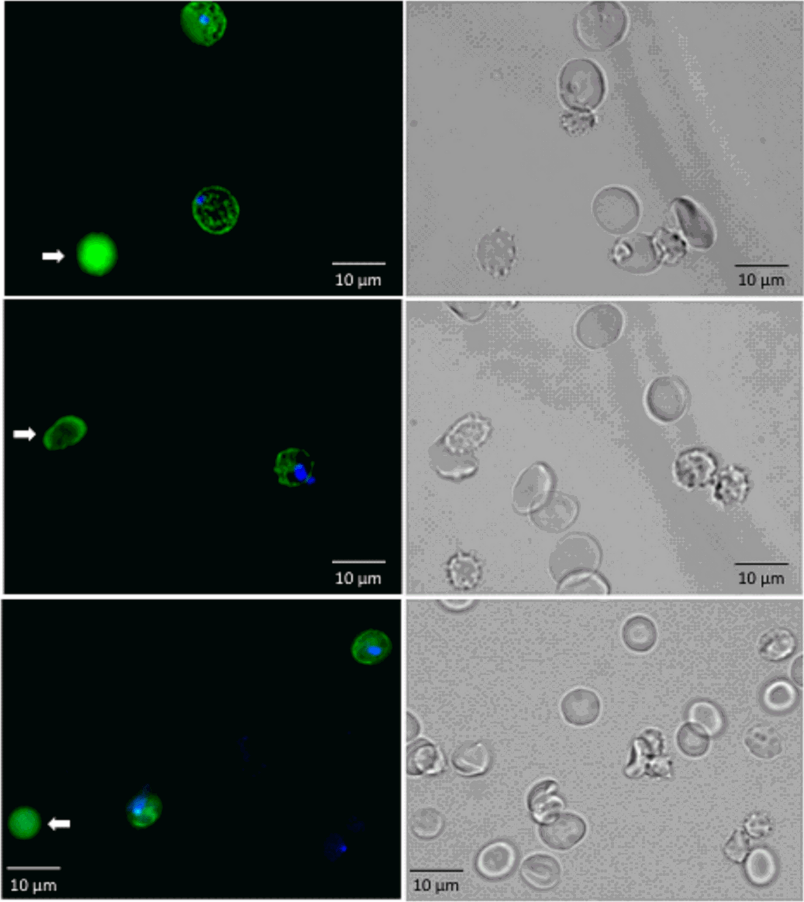 图5. P.f.-RBCs 通过微型装置后的荧光显微镜图像。
图5. P.f.-RBCs 通过微型装置后的荧光显微镜图像。
在疟疾患者中,使用青蒿素类药物治疗后,血液阶段寄生虫的清除速度比用其他抗疟药(如奎宁)更快。青蒿素在寄生虫的无性生命周期的早期起作用,在幼虫形式成熟为潜在致病性细胞粘附形式之前就被清除。这两种药效学效应是奎宁所不能达到的,据信可以降低东南亚和撒哈拉以南非洲严重疟疾的发病率和死亡率。研究人员观察到接受青蒿素衍生物治疗的患者的 O-iRBC 计数上升速度比接受奎宁治疗的患者快,这可能反映了青蒿素衍生物在杀死或破坏循环性环状阶段寄生虫方面的更大功效,与之一致的是,受感染的红细胞剔除不会发生在脾切除患者或体外培养中,这意味着机械相互作用参与了剔除。该研究开发了一种微流体装置,可在体外复制恶性疟原虫感染的红细胞的脾脏机械剔除,使曾经感染的红细胞群体去除寄生虫,这表明可以通过机械力在没有吞噬细胞参与的情况下实现剔除。该设备的逐步优化适用于进一步探索疟疾和其他溶血性贫血的病理生理学。
原文链接:https://www.nature.com/articles/s41598-021-01568-w
作为全球高品质临床前药物开发服务供应商,安必奇生物拥有丰富的体外模型构建、器官芯片开发等代理经验。提供优良、完善的器官芯片设计及开发服务,以帮助客户获取高仿、节能的生理学研究及药物开发工具。目前已建立能够模拟心脏、肝脏、肺、肾、脑、肠等器官的微结构和功能的芯片模型。可从材料、制备技术、仪器、以及商业化等方面实现个性化定制。欢迎免费咨询!
24小时服务在线

