角膜上皮是角膜的最外层,由存在于角膜缘上皮基底层的角膜上皮干细胞(corneal epithelial stem cells, CESCs)再生而来。CESCs 的主要功能是管理伤口愈合和平衡等过程,以维持角膜透明度。这些成体组织驻留干细胞占总角膜上皮的 3-5%,通常处于静止状态。然而,维持 CESCs 干性背后的分子机制仍不清楚,其中包括 microRNA(miRNAs)的表观遗传调节。

MicroRNAs(miRNAs)是一种内源性非编码 RNA 分子(约 18-24 个核苷酸),可靶向调节目标 mRNA 转录的蛋白质水平,而无需对基因序列进行任何修改。已知 miRNA 积极参与各种细胞过程,如增殖、分化、细胞代谢、体内平衡以及细胞凋亡等。先前的研究中,通过小 RNA 测序 将 CESCs 与分化的中央角膜上皮细胞进行比较。其中 hsa-miR-3168,hsa-miR-21-5p,hsa-miR-143-3p,hsa-miR-150-5p,hsa-miR-10a-5p 和 hsa-miR-1910-5p 被确认在富集的 CESCs 中高表达,并通过 qPCR 进行了验证。根据锁定核酸原位杂交,发现 hsa-miR-143-3p 在角膜上皮的基底层表达,且仅在小细胞簇中表达,表明其可能与 CESCs 有关。
2022 年 7 月 6 日,印度泰米尔纳德邦卡拉伊库迪阿拉加帕大学的研究人员在 Scientific Reports 杂志上发表了题为“Hsa-miR-143-3p 抑制人角膜上皮干细胞中的 Wnt-β-catenin 和 MAPK 信号传导”的研究论文。该研究预测了 hsa-miR-143-3p 的靶基因,并进行了路径分析,以选择靶点进行功能研究。结果显示,hsa-miR-143-3p 抑制剂转染的细胞中 β-catenin、活性 β-catenin 和 ERK2 的表达高于对照组细胞,其局部核表达表明 Wnt 和 MAPK 信号的激活。因此,hsa-miR-143-3p 可能通过抑制 Wnt 和 MAPK 信号通路与 CESCs 的维持相关联。

对于 hsa-miR-143-3p,使用 mirWalk 和 mirDIP 分别鉴定了 1229 和 1661 个靶基因。共有 276 个共同靶基因被提交给 KEGG mapper,推测的靶基因被归入 231 条 KEGG 途径。这些通路包括 MAPK 通路、Wnt 信号通路、与干细胞多能性相关的信号通路以及 PI3K-AKT 等通路。其中,杂乱片段极性蛋白 3(DVL3)、赖氨酸乙酰转移酶 6A(KAT6A)、Kirsten 大鼠肉瘤 2 病毒癌基因同源物(KRAS)、丝裂原活化蛋白激酶 1(MAPK1)/ERK2 和丝裂原活化蛋白激酶 14(MAPK14)/p38 MAPK 是参与调节干细胞多能性的信号通路的五个靶标,它们被选择用于进一步分析。
hsa-miR-143-3p 模拟物和抑制物分别转染细胞后,与对照细胞相比,模拟物转染的细胞表现出 hsa-miR-143-3p 表达增加,抑制剂转染组则表现出表达降低(图 1a)。hsa-miR-143-3p 的五个选定靶标 mRNA 的表达在模拟物转染的细胞中下调,而在抑制剂转染的细胞中,它们的表达显著上调(图 1b)。同样,在蛋白质水平上,通过Western blot(图 2)和免疫染色(图 3),模拟物转染的细胞与对照组细胞相比,DVL3、KRAS、MAPK1 和 MAPK14 的表达减少。
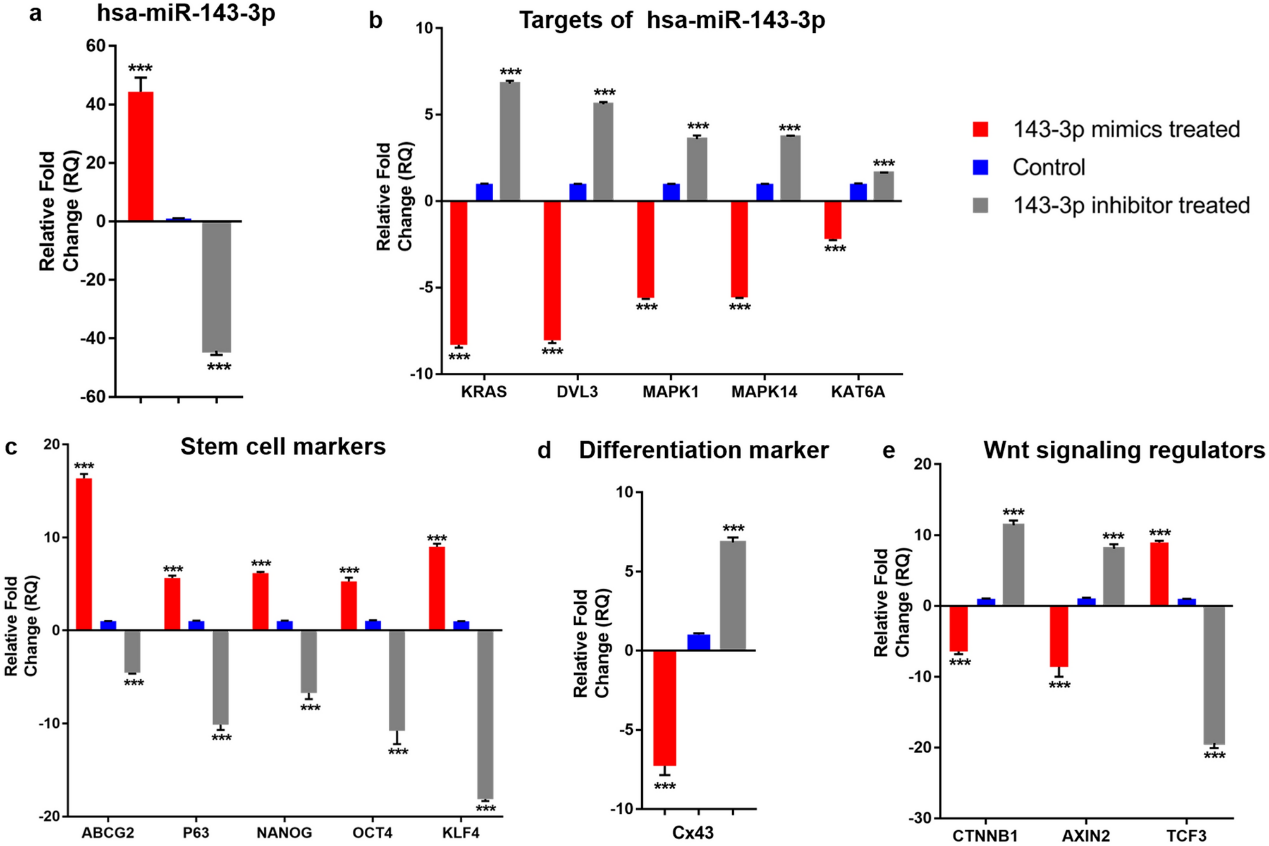 图1. hsa-miR-143-3p 转染的细胞的 mRNA 表达情况。
图1. hsa-miR-143-3p 转染的细胞的 mRNA 表达情况。
在 mRNA 水平,与对照细胞相比,模拟物转染的细胞具有显著更高的干细胞标志物表达——(i)通用干细胞标志物 ABCG2,(ii)角膜缘干细胞标志物 p63α,(iii)胚胎干细胞标志物 OCT4、NANOG 和 KLF4(图 1C)。相比之下,分化标志物连接蛋白 43(Cx43)的表达在模拟物转染的细胞中降低。另一方面,在抑制剂转染的细胞中,干细胞标志物的表达降低而 Cx43 表达增加(图 1D、图 3)。模拟物转染细胞的共聚焦分析发现,与对照相比,ABCG2 和 p63α 双阳性的细胞数量显著增加。在抑制剂转染的细胞中,没有细胞同时表达 ABCG2 和 p63α(图 3)。Western blot 分析显示模拟物转染的细胞中 ABCG2 和 ΔNp63α 的表达水平上调,Cx43 的表达下调(图 2)。
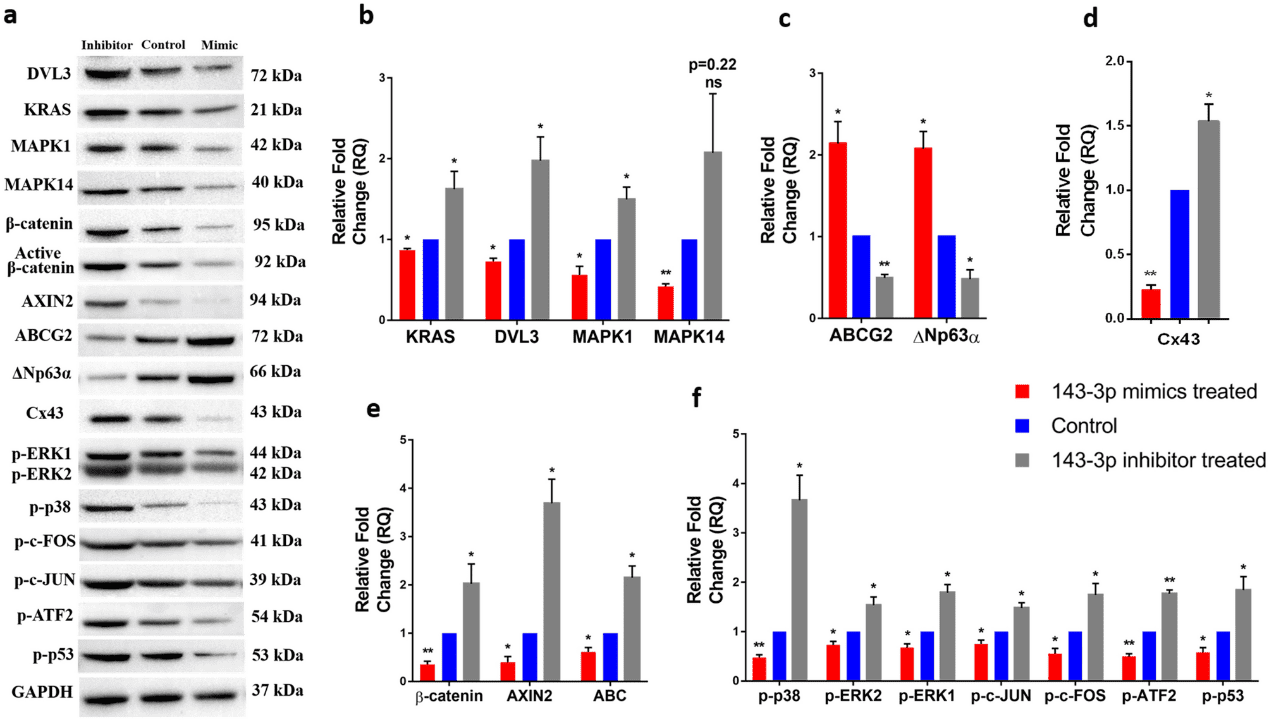 图2. 在二维培养系统中生长的 hsa-miR-143-3p 转染的细胞的蛋白质表达情况。
图2. 在二维培养系统中生长的 hsa-miR-143-3p 转染的细胞的蛋白质表达情况。
与对照组相比,模拟物处理的细胞中 Wnt 信号调节因子 CTNNB1 和 AXIN2 的表达被下调,Wnt 信号转录抑制因子 TCF3 被上调(图 1E),而在抑制剂转染的细胞中则相反。在蛋白质水平上,免疫染色(图 3)和 Western blots 显示,β-catenin、活性 β-catenin 和 AXIN2 的表达在模拟物转染的细胞中减少。在抑制剂转染的细胞中,与对照组相比,β-catenin、活性 β-catenin 和 AXIN2 的表达增加(图 2)。MAPK信号调节因子p-ERK1/2、p-p38、p-c-JUN、p-c-FOS、p-ATF2 和 p-p53 在模拟物转染的细胞中被下调,在抑制剂转染的细胞中被上调(图 2)。
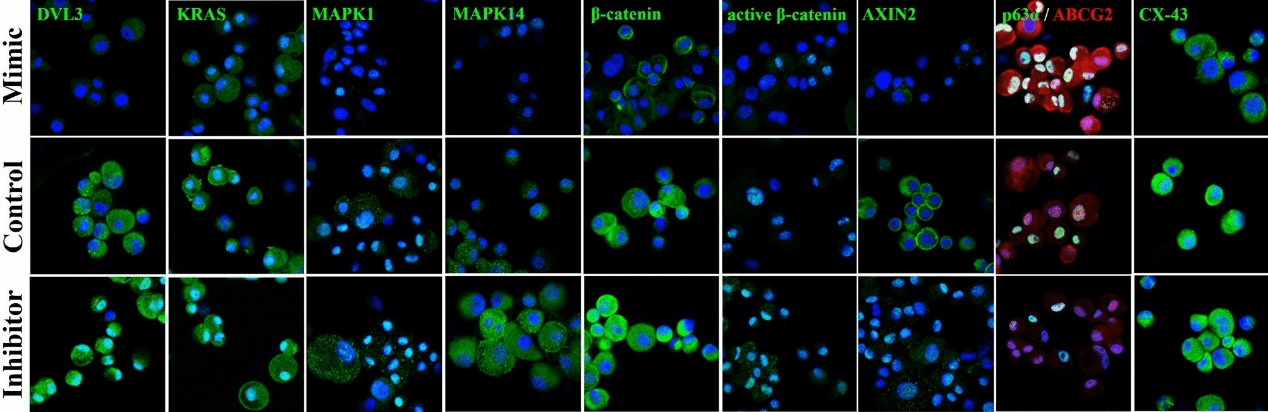 图3. hsa-miR-143-3p转染的细胞中蛋白质表达的定位。
图3. hsa-miR-143-3p转染的细胞中蛋白质表达的定位。
为了确认转染培养物中干细胞的存在,进行了集落形成试验。与对照组和抑制剂处理的细胞相比,模拟物处理的细胞显示出更高的菌落形成效率百分比。此外,与对照组相比,全克隆样集落的百分比也有显著增加。抑制剂处理的细胞没有产生这种较大的集落(图 4)。因此,hsa-miR-143-3p 的高表达增加了集落形成的效率,并支持全克隆样集落的形成。
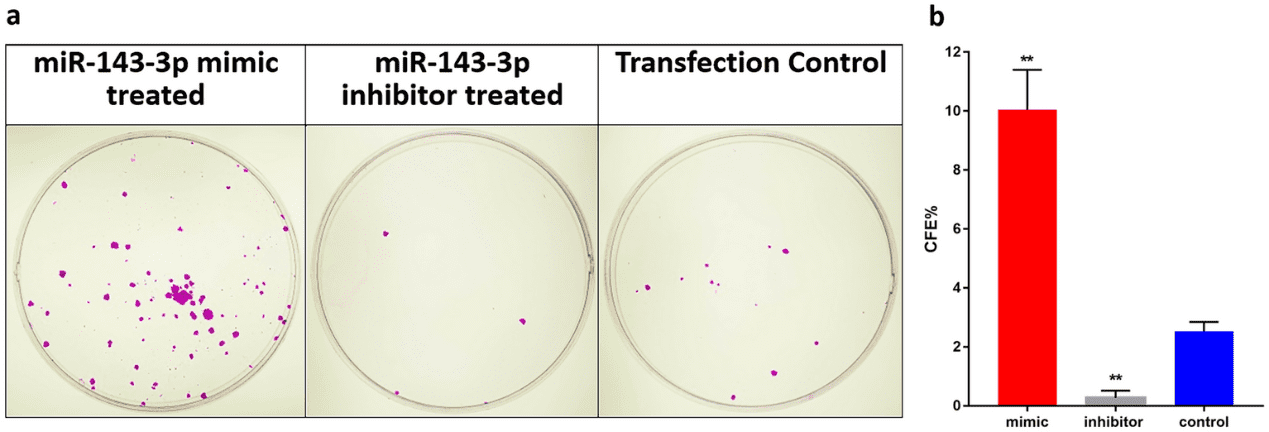 图4. hsa-miR-143-3p 转染的细胞的集落形成潜力。
图4. hsa-miR-143-3p 转染的细胞的集落形成潜力。
在 3D RAFT TEs 上生长的原代角膜上皮细胞,在转染模拟物后以下蛋白的表达均减少 ——(i)hsa-miR-143-3p靶标:DVL3、KRAS、MAPK1 和 MAPK14;(ii)分化标志物:Cx43;(iii)Wnt 信号调节因子:AXIN2、β-catenin 和活性 β-catenin;(iv)MAPK信号调节因子:p-ERK1/2、p-p38、p-c-JUN、p-c-FOS、p-ATF2 和 p-p53。然而,与对照组相比,干细胞标志物 ABCG2 和 ΔNp63α 在模拟物转染的细胞中表达增加(图 5)。在模拟物转染的细胞中,β-catenin、活性 β-catenin 和 ERK2 的阳性仅限于细胞膜内。但在抑制剂转染的细胞中,膜和细胞核都有阳性反应,表明存在核转位(图 6)。
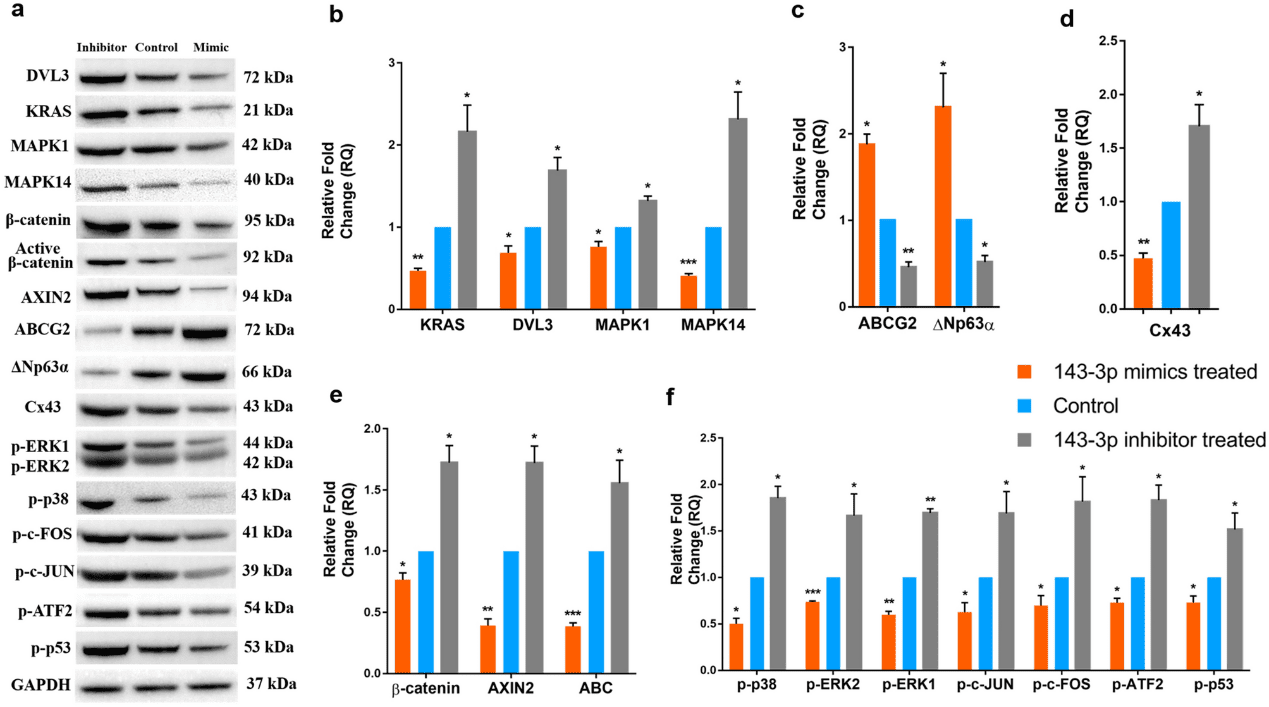 图5. 在三维 RAFT 培养系统中生长的 hsa-miR-143-3p 转染的细胞的蛋白质表达。
图5. 在三维 RAFT 培养系统中生长的 hsa-miR-143-3p 转染的细胞的蛋白质表达。
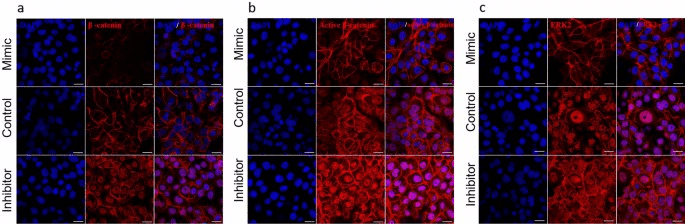 图6. β-catenin、活性 β-catenin 和 ERK2 在三维 RAFT 中转染的细胞中的表达定位。
图6. β-catenin、活性 β-catenin 和 ERK2 在三维 RAFT 中转染的细胞中的表达定位。
近期的研究在各种干细胞中已经发现了 miRNAs 的重要调节作用。MiRNAs 通过选择性地靶向所涉及的分子来调节信号通路。虽然 hsa-miR-143-3p 的表达在各种眼部组织中被确认,但其功能关联尚未被探知。在该研究中,异位表达的 hsa-miR-143-3p 增加了培养的角膜上皮细胞的集落形成潜力,同时基于大小和形态全克隆样集落的数量增加。此外,在模拟物转染的细胞中,干细胞标志物的表达增加,而分化标志物的表达减少。因此,这些结果共同表明,hsa-miR-143-3p 与维持 CESCs 的干性有关。先前有报告指出 Wnt 和 MAPK 信号与干细胞的维持和分化有关。实验发现,Wnt 信号调节因子和 MAPK 信号调节因子的表达均在模拟物转染细胞中下调,表明 Wnt-β-catenin 和 MAPK 信号传导受到抑制。接下来还需要进行功能研究,对于确认预测基因是否是 hsa-miR-143-3p 的直接靶标及其在维持干性中的作用至关重要。
原文链接:https://www.nature.com/articles/s41598-022-15263-x
安必奇生物致力于为国内外客户提供 MicroRNA Agomir/Antagomir 相关综合服务。完善的服务涵盖 miRNA Agomir/ Antagomir 的设计,合成,筛选,递送以及应用开发等各个环节。为您的科学研究提供更加低成本且省时的解决方案。欢迎免费咨询!
24小时服务在线

