包括外泌体在内的细胞外囊泡(Extracellular vesicles, EV)是细胞间通讯的重要参与者。EV 是双层脂质封闭的颗粒,几乎所有哺乳动物的细胞类型都会分泌这些颗粒。迄今为止,一些研究已经确定了肿瘤来源的外泌体或 EV 在肿瘤发展各个阶段中的作用,包括发育、血管生成、逃避免疫监视、转移以及侵袭性表型和多药耐药性的获得等。
miRNA 属于一类非编码小 RNA,它们通过降解 mRNA 调节蛋白质水平,在调控基因表达中发挥重要作用。一些研究显示,miRNA 在外泌体中富集,并且可以转移到邻近和远处的细胞中,在肿瘤生长中发挥功能作用。近期,一些报道表明 miR-1260b 与化学敏感性、淋巴结转移、细胞增殖和凋亡,以及各种肿瘤细胞的转移相关。然而,要将 miR-1260b 作为临床生物标志物应用还需要进一步的研究验证。
2021 年 7 月 28 日,来自韩国牙山医学中心的研究团队在 Cell Death & Disease 杂志上发表了题为《非小细胞肺癌外泌体 miR-1260b 通过抑制 HIPK2 促进肿瘤转移》一文。研究了源自非小细胞肺癌(non-small cell lung cancer, NSCLC)的外泌体 miR-1260b 在肿瘤发展中的作用。研究证实外泌体 miR-1260b 通过调节 HIPK2 促进人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVEC)血管生成和 NSCLC 转移,可以作为肺癌的预后标志物。

为探究 miR-1260b 对 HUVEC 血管生成的影响,使用人 miR-1260b 或其互补拮抗剂 anti-miR-1260b 进行了转染。结果显示,miR-1260b 处理增加了血管形成,而 anti-miR-1260b 处理显示没有效果(图1A)。这些结果支持 miR-1260b 在 HUVECs 中的血管生成作用。研究人员采用五种算法预测了 miR-1260b 的 40 个潜在靶基因,选择了众所周知在肿瘤血管生成中的发挥作用的 HIPK2 进行进一步验证。结果发现 HIPK2 在其 3' UTR 中具有三个 miR-1260b 结合位点(图1B)。此外,三重突变(MUT1/2/3)完全消除了 miR-1260b 的作用(图1B)。这些结果表明 miR-1260b 直接靶向 HIPK2。
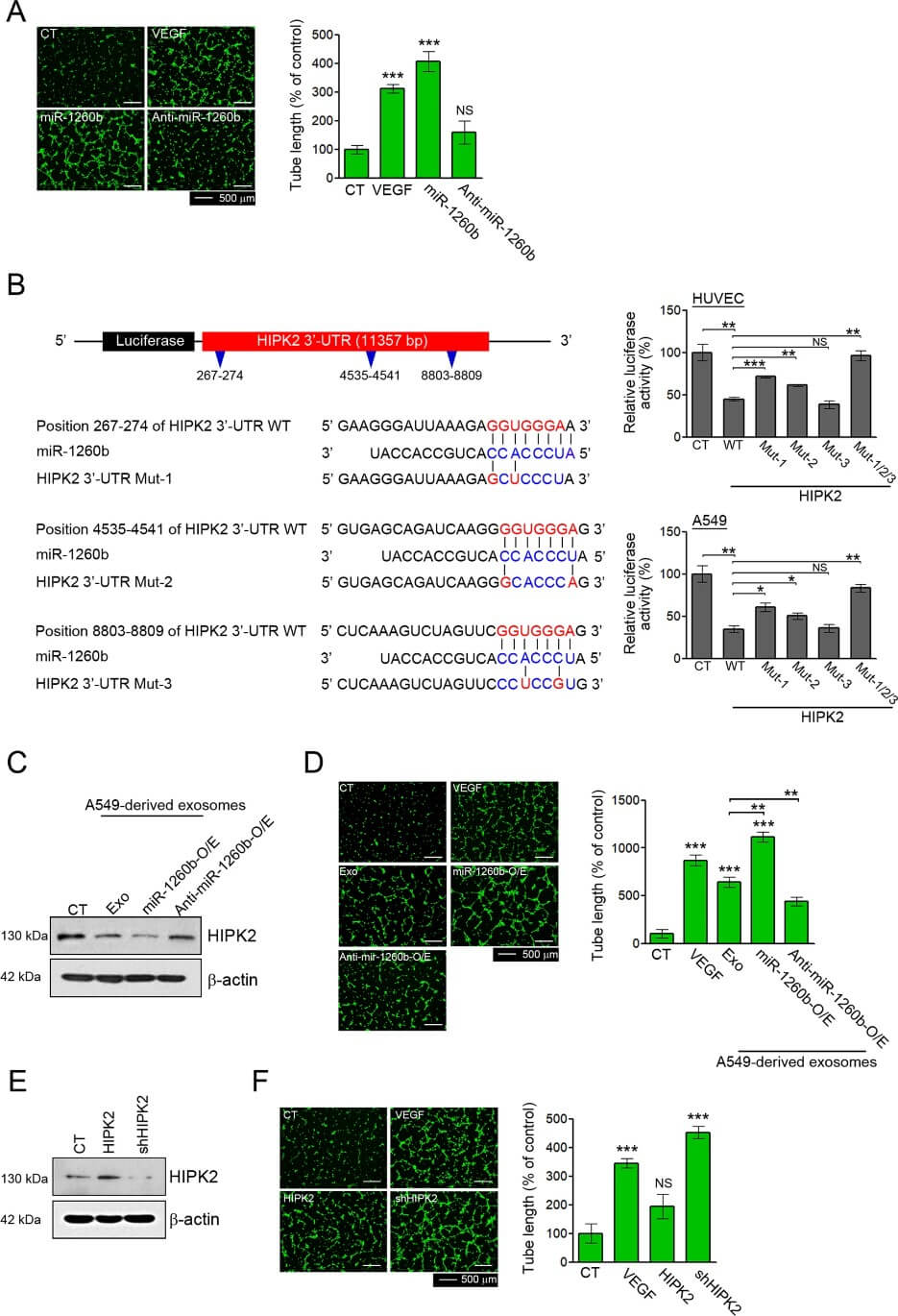 图1. 外泌体 miR-1260b 通过直接调节 HIPK2 对血管生成的影响。
图1. 外泌体 miR-1260b 通过直接调节 HIPK2 对血管生成的影响。
为了进一步验证外泌体 miR-1260b 在 HUVEC 中的血管生成作用,从 A549 细胞及其稳定细胞系(过表达 miR-1260b 和 anti-miR-1260b 的 A549 细胞)中分离出外泌体。当使用外泌体处理 HUVEC 时,证实了 miR-1260b 的诱导和 HIPK2 的减少(图1C)。源自 anti-miR-1260b 过表达 A549 细胞的外泌体处理比来自 A549 细胞的外泌体更能促进血管的形成。此外,来自 anti-miR-1260b 过表达 A549 细胞或 anti-miR-1260b 处理的外泌体减弱了 A549 细胞来源的外泌体形成血管的能力(图1D)。使用 HIPK2 shRNA 或 HIPK2 表达载体处理 HUVECs 来探究 HIPK2 在血管生成中的作用。在 HIPK2 抑制或过表达的条件下(图1E),HIPK2 抑制显著增强了血管的形成,而 HIPK2 过表达没有效果(图1F)。因此,证明了外泌体 miR-1260b 通过降低 HUVECs 中 HIPK2 蛋白水平导致了血管形成能力的增强。
一些研究表明 miR-1260b 还起到调节肿瘤转移的作用。为了进一步研究 miR-1260b/HIPK2 介导的 NSCLC 变化的生物学后果,根据 HIPK2 表达探索了 miR-1260b 的细胞迁移能力。通过蛋白质印迹证实了 shRNA 或 miR-1260b 对 HIPK2 表达的抑制(图2A)。虽然 miR-1260b 处理不影响 NSCLC 细胞的增殖,但 shRNA 或 miR-1260b 对 HIPK2 的抑制显著增强了 NSCLC 细胞的迁移和侵袭性,而 miR-1260b 在降低 HIPK2 表达的情况下不影响细胞迁移能力(图2B,2C )。这些结果与通过用源自 A549 的外泌体或源自miR-1260b 过表达的 A549 细胞的外泌体处理抑制 HIPK2 的结果相似(图2D,2E)。此外,在尾静脉注射后,miR-1260b 的引入导致比 A549 细胞更高的肺转移能力(图2F)。总的来说,这些数据表明外泌体 miR-1260b 通过调节 HIPK2 的表达来促进 NSCLC 细胞系的细胞迁移。
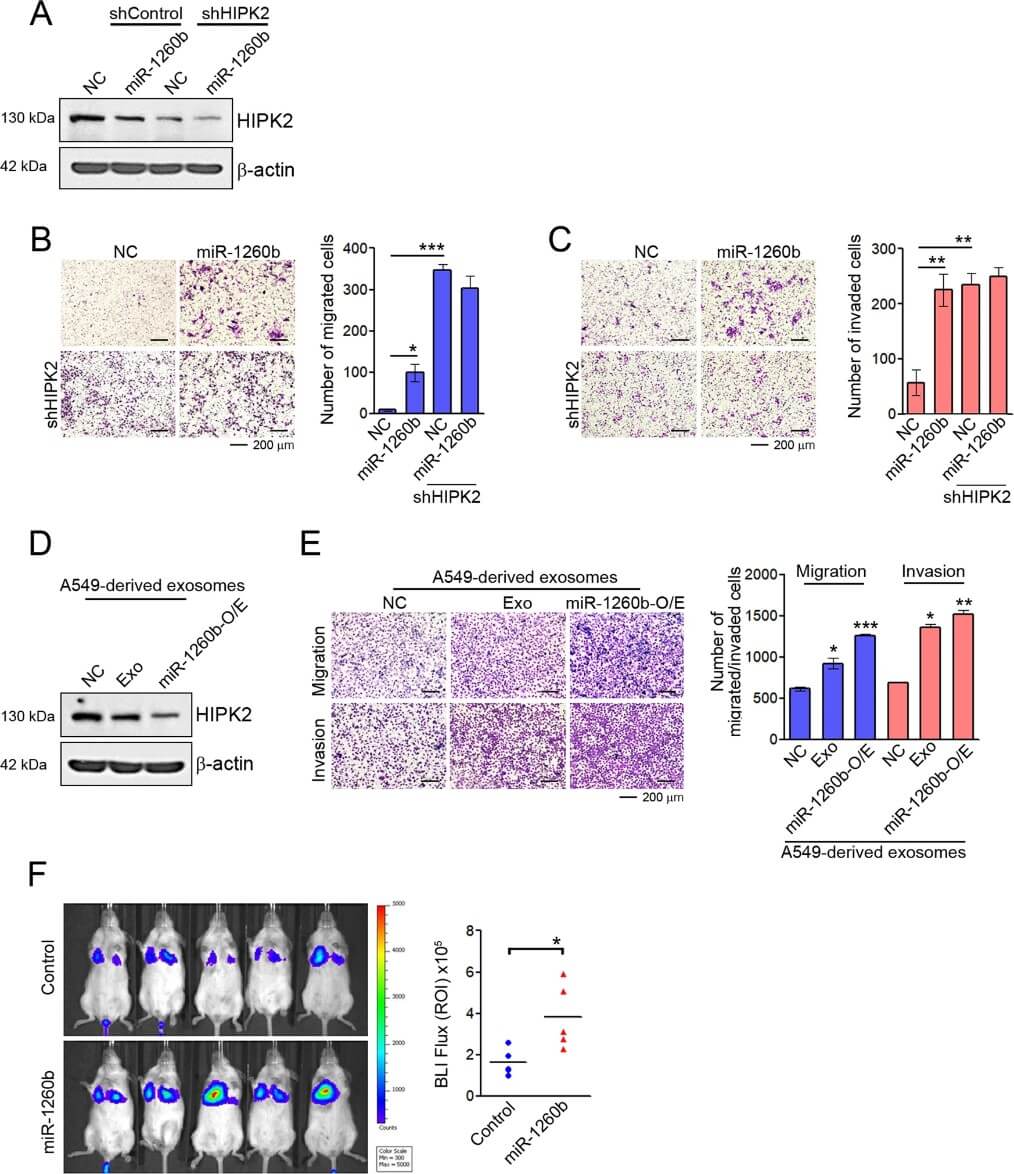 图2. 外泌体miR-1260b对NSCLC迁移和侵袭的影响。
图2. 外泌体miR-1260b对NSCLC迁移和侵袭的影响。
肿瘤来源的外泌体可将多药耐药相关蛋白、mRNA 和 miRNA 转移到受体细胞,导致对抗癌药物耐药。于是研究了 miR-1260b 是否影响 NSCLC 细胞对顺铂的敏感性。流式细胞显示,miR-1260b 处理抑制了 A549 和 PC-9 细胞中顺铂诱导的细胞凋亡,而 anti-miR-1260b 处理减弱了 miR-1260b 对顺铂诱导的细胞凋亡的抑制(图3A,3B)。与 A549 和 PC-9 细胞的结果不同,在 Calu-1 细胞中发现了相反的模式(图3D)。为了验证外泌体 miR-1260b 是否导致对顺铂的耐药性,如上述结果所示,使用 A549 来源的外泌体、miR-1260b 过表达细胞来源的外泌体或 anti-miR-1260b 过表达的 A549 细胞处理细胞,发现含有 miR-1260b 的外泌体处理可抑制顺铂诱导的凋亡。与A549来源的外泌体相比,这些效应在源自过表达 miR-1260b 的 A549 细胞外泌体处理的细胞中更为显著。此外,来自anti-miR-1260b 过表达 A549 细胞的外泌体减弱了 miR-1260b 对顺铂诱导的细胞凋亡的抑制(图3E),这也被凋亡信号所证实(图3F)。这些发现表明外泌体 miR-1260b 降低了 NSCLC 细胞对顺铂的敏感性。
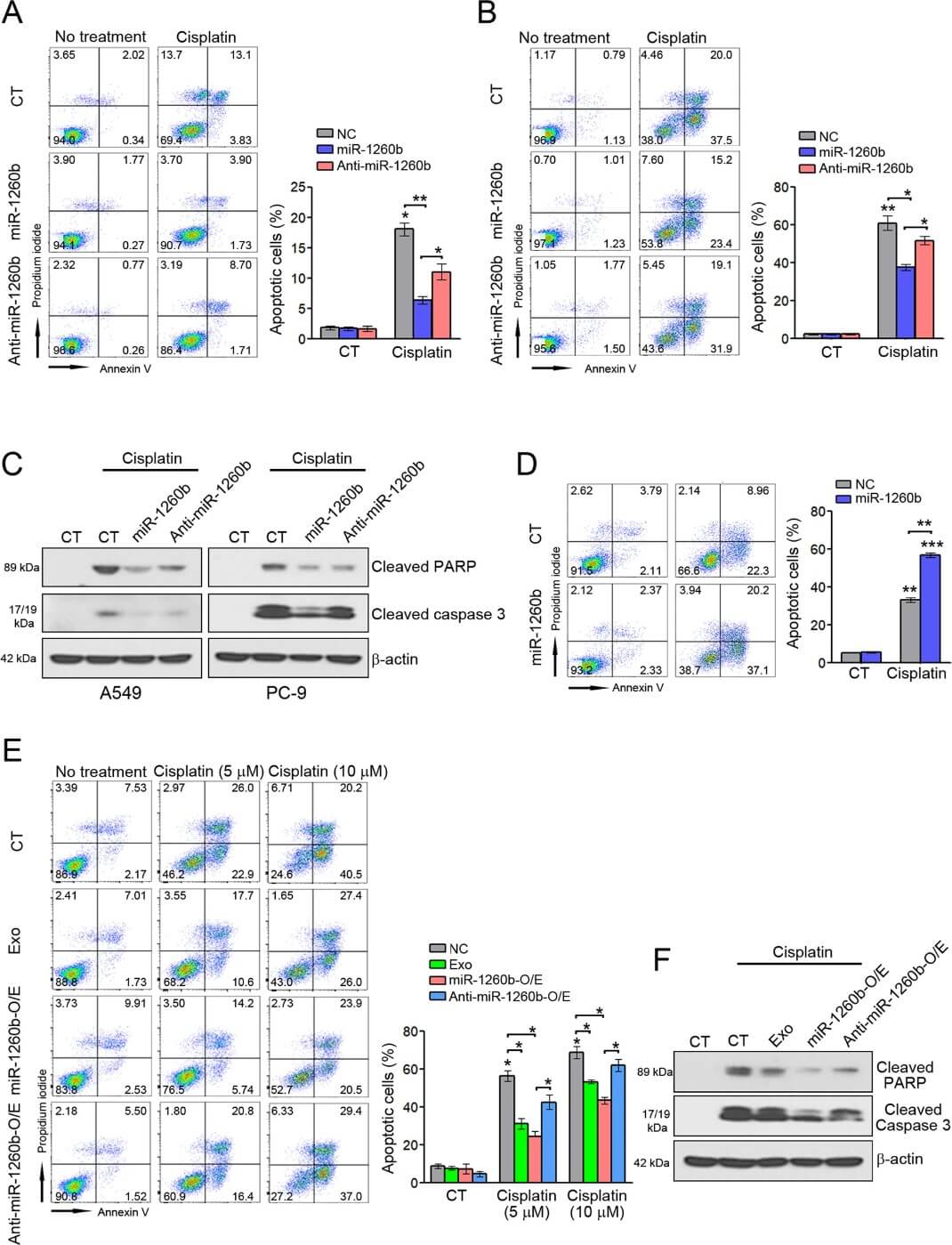 图3. 外泌体 miR-1260b 对顺铂诱导的细胞凋亡的影响。
图3. 外泌体 miR-1260b 对顺铂诱导的细胞凋亡的影响。
为了验证 miR-1260b 和 HIPK2 之间的关系及其临床意义,使用 qRT-PCR 分析了 124 对 NSCLC 组织和邻近非癌肺组织中 miR-1260b 和 HIPK2 的表达水平。与相应的非癌肺组织相比,NSCLC 组织中的 HIPK2 转录本显著降低(83.1%,图4A,4B),而 NSCLC 组织中的 miR-1260b 表达远高于非癌肺组织(99.1%,图4D,4E)。当根据肿瘤分期评估 HIPK2 和 miR-1260b 时,无论肿瘤分期如何,HIPK2 均降低而 miR-1260b 增强(图4C、4F)。与这些结果一致,散点图显示 miR-1260b 水平与 HIPK2 表达呈强烈的负相关(图4G),这在远端转移的患者中更为明显(图4H)。此外,Kaplan-Meier 生存分析显示,HIPK2 低表达患者的总生存率低于高表达患者(图4I)。然而,具有不同 miR-1260b 表达水平的患者存活率没有显著差异(图4J)。这些结果表明 HIPK2 表达与 miR-1260b 表达呈负相关,并且 HIPK2 可作为 NSCLC 中重要的预后指标或转移预测指标。
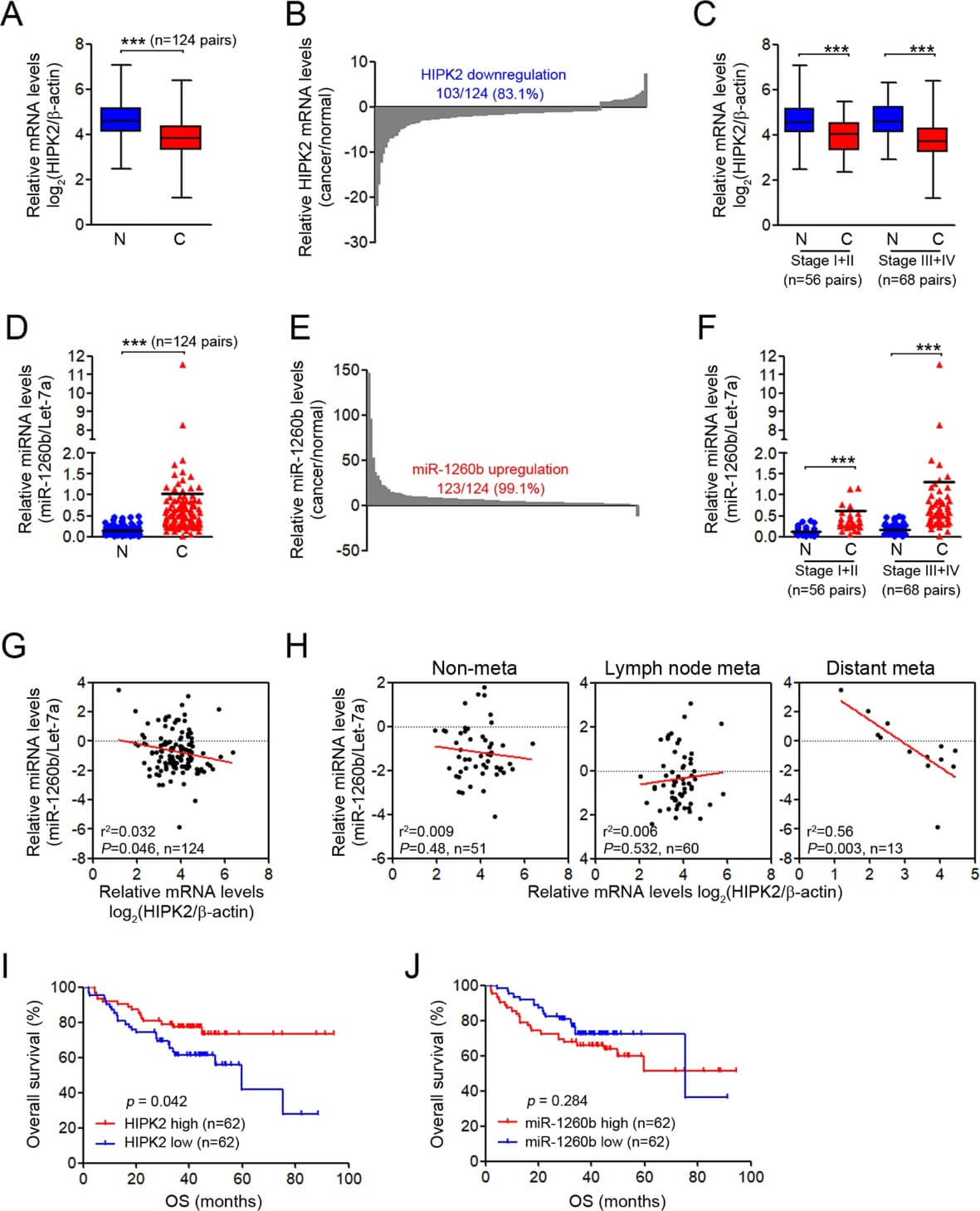 图 4. NSCLC 组织中 HIPK2 与 miR-1260b 表达的关系。
图 4. NSCLC 组织中 HIPK2 与 miR-1260b 表达的关系。
之前的研究已经证实,与其他 miRNA 相比,let-7a-5p 在健康供体和 NSCLC 患者的外泌体中浓度相当。因此,使用 let-7a-5p 作为对照来标准化外泌体 miR-1260b 的表达。NSCLC 患者中外泌体 miR-1260b 的表达水平高于健康供体(图5A),并且在晚期阶段比在早期阶段(图5B,5C)更高。与无转移的患者相比,有转移的患者外泌体 miR-1260b 表达显著增加(图5D)。此外,Kaplan-Meier 生存分析显示,外泌体 miR-1260b 水平高的患者的总生存率低于水平低的患者(图5E)。总之,实验数据表明外泌体 miR-1260b 在转移患者中高表达,外泌体 miR-1260b 作为 NSCLC 的预后指标或转移预测指标,优于细胞 miR-1260b。
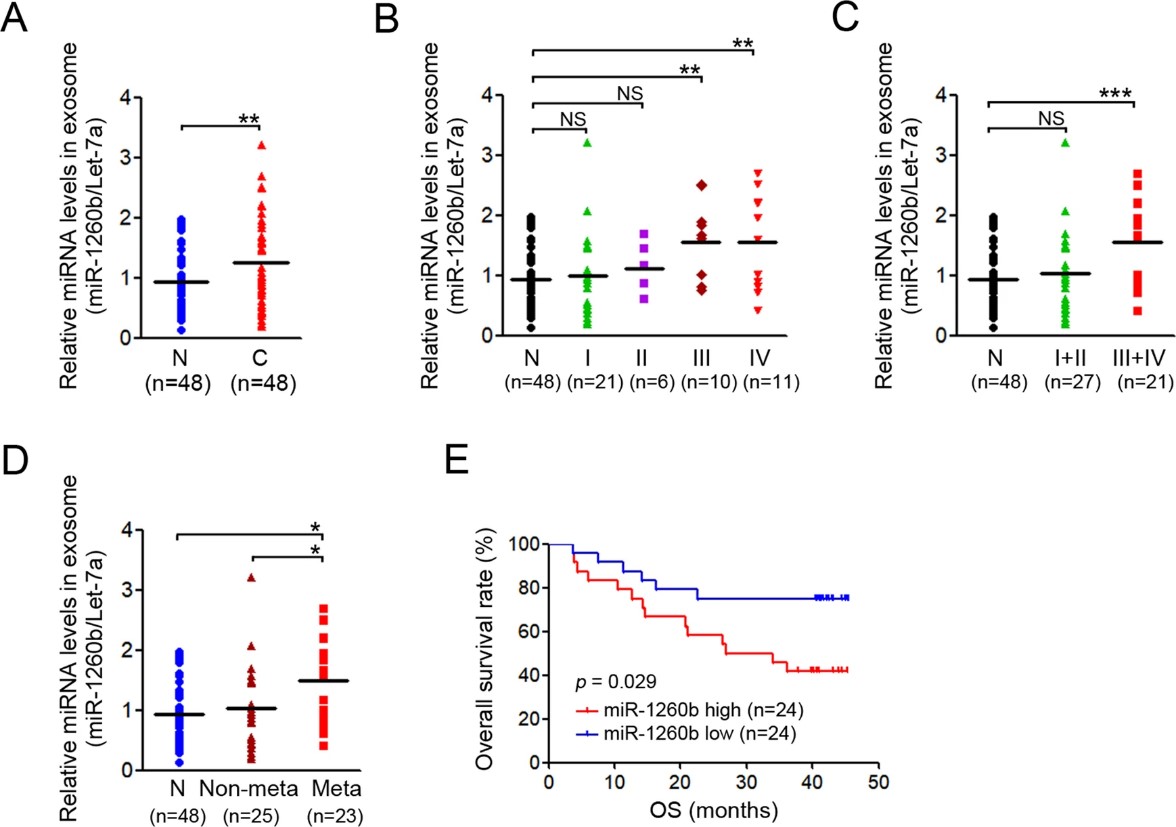 图 5. NSCLC 中外泌体 miR-1260b 的病理特征。
图 5. NSCLC 中外泌体 miR-1260b 的病理特征。
在肿瘤来源的外泌体导致肿瘤发展的背景下,该研究首次表明 miR-1260b 通过靶向内皮细胞中的 HIPK2 来增强血管生成。此外,外泌体 miR-1260b 或 HIPK2 的抑制导致 NSCLC 细胞的迁移率和顺铂耐药性增强。在 NSCLC 患者中,HIPK2 在肿瘤组织中的水平显著低于正常肺组织,而 miR-1260b 在肿瘤组织中的水平较高。HIPK2 和 miR-1260b 表达呈负相关,这种相关性在远端转移中很强。总之,该研究发现了外泌体 miR-1260b 在血管生成、细胞流动性和耐药性等多方面发挥作用。这些发现表明,对肿瘤来源的外泌体的调节可能是治疗肿瘤的潜在方案。
原文链接:
https://www.nature.com/articles/s41419-021-04024-9
作为全球高品质生物实验服务供应商,安必奇生物致力于为国内外客户提供 MicroRNA Agomir / Antagomir 相关综合服务。完善的服务涵盖 miRNA Agomir / Antagomir 的设计,合成,筛选,递送以及应用开发等各个环节。为您的科学研究提供更加省时的解决方案。欢迎免费咨询!
24小时服务在线

