乙型肝炎病毒(HBV)引起的乙型肝炎是一种全球公共卫生威胁,会造成相当多的与肝脏相关的发病和死亡。每年约有 60 万人死于 HBV 相关的肝病或肝细胞癌(hepatocellular carcinoma, HCC),HBV 对 50% 的 HCC 负有责任。HBV 基因组包含一个紧凑的 3.2kb 的基因组,它以部分双链、松弛的环状 DNA(relaxed circular DNA, rcDNA)基因组形式存在,与 HBV 聚合酶共价连接。病毒进入后,rcDNA 进入细胞核并转化为全双链 DNA,其本身通过连接转化为共价闭合的环状 DNA(covalently closed circular DNA, cccDNA)。cccDNA是 HBV DNA 的稳定形式,是其在受感染的肝细胞中持续存在和向后代细胞传播的原因。
HBV 基因组编码的已知基因有四个,分别称为 C、X、P 和 S。核心蛋白由基因 C(HBcAg)编码,早期抗原(HBeAg)是通过前核心蛋白的蛋白水解加工产生的。基因 P 编码 DNA 聚合酶,基因 S 编码表面抗原(HBsAg)。HBeAg 和 HBsAg 被认为会诱导 T 细胞耐受和 T 细胞耗竭,从而导致病毒持续存在,因此急需开发新的 HBV 治愈方案。小干扰 RNA(siRNA)能够介导靶向 mRNA 转录物切割、抑制基因表达和损害活细胞内的基因功能。鉴于能够从本质上敲除任何感兴趣的基因,通过 siRNA 的 RNAi 在基础研究和临床应用中引发了极大的关注。

2022 年 2 月 11 日,苏州日博生命科学有限公司领导的联合研究团队在 Signal Transduction and Targeted Therapy 杂志上发表了题为“可离子化脂质体 siRNA 疗法能够有效和持久地治疗乙型肝炎”的研究论文。该研究开发了一种新型可电离类脂质纳米颗粒 (RBP131)和先进的冻干技术,能够将针对脂蛋白 B(apolipoprotein B, APOB)的 siRNA 递送到肝细胞。在瞬时和转基因小鼠模型中的疗效研究显示,病毒 RNA 和抗原(HBsAg 和 HBeAg)以及病毒 DNA 的表达在血液循环和肝脏组织中都被抑制,其幅度呈多对数递减,与剂量和时间有关。此外,毒性特征表明其安全性令人满意。因此,本研究为治疗乙型肝炎提供了一个有效的核酸递送系统和一个有前景的 RNAi 制剂。

RBP131/siRNA 复合物(图 1a)通过两步混合法或 KrosFlo® Research IIi 切向流过滤系统制备,简而言之,将关键的可电离脂质 LC8 与 DPPE-mPEG2000、胆固醇和 siRNA 以指定的摩尔比和质量比混合。使用冷冻电镜观察其形态,表明 RBP131/siRNA 复合物是由具有双层和多层结构的球形囊泡组成(图 1b)。由于药物运输和保存对于临床药物应用至关重要,研究人员为 RBP131/siRNA 脂质体制剂建立了先进的冷冻干燥技术。分析了液体制剂(0 周)和储存在 -20°C、4°C 或 25°C 下的冻干制剂的外观、包封效率(EE)、粒度、多分散性指数(PDI)和 zeta 电位,并分别在第 1 周、第 2 周、第 3 周和第 4 周重组(图 1c - 1f)。结果表明,液体制剂外观呈白色或淡黄色,而冻干制剂是白色粉末(图 1c)。重组的冻干制剂的外观与液体制剂相同。动态光散射(DLS)检测显示,RBP131/siRNA 的尺寸和 PDI 在三个温度下都很稳定(图 1d,1e)。RBP131/siRNA 的封装效率在 -20°C 时稳定,在 4°C 时高于 90%,在 25°C 时高于 80%(图 1f)。在中性 pH 值的 PBS 缓冲液中,该纳米颗粒的 zeta 电位几乎是中性的(0.089 mV)(图 1g)。一般来说,RBP131/siRNA 纳米颗粒的大小从 60 到 100 nm 不等。将制剂保存在 4°C 甚至 4 周时,PDI<0.2,>90% 的 siRNA 被 RBP131 捕获(图 1g)。
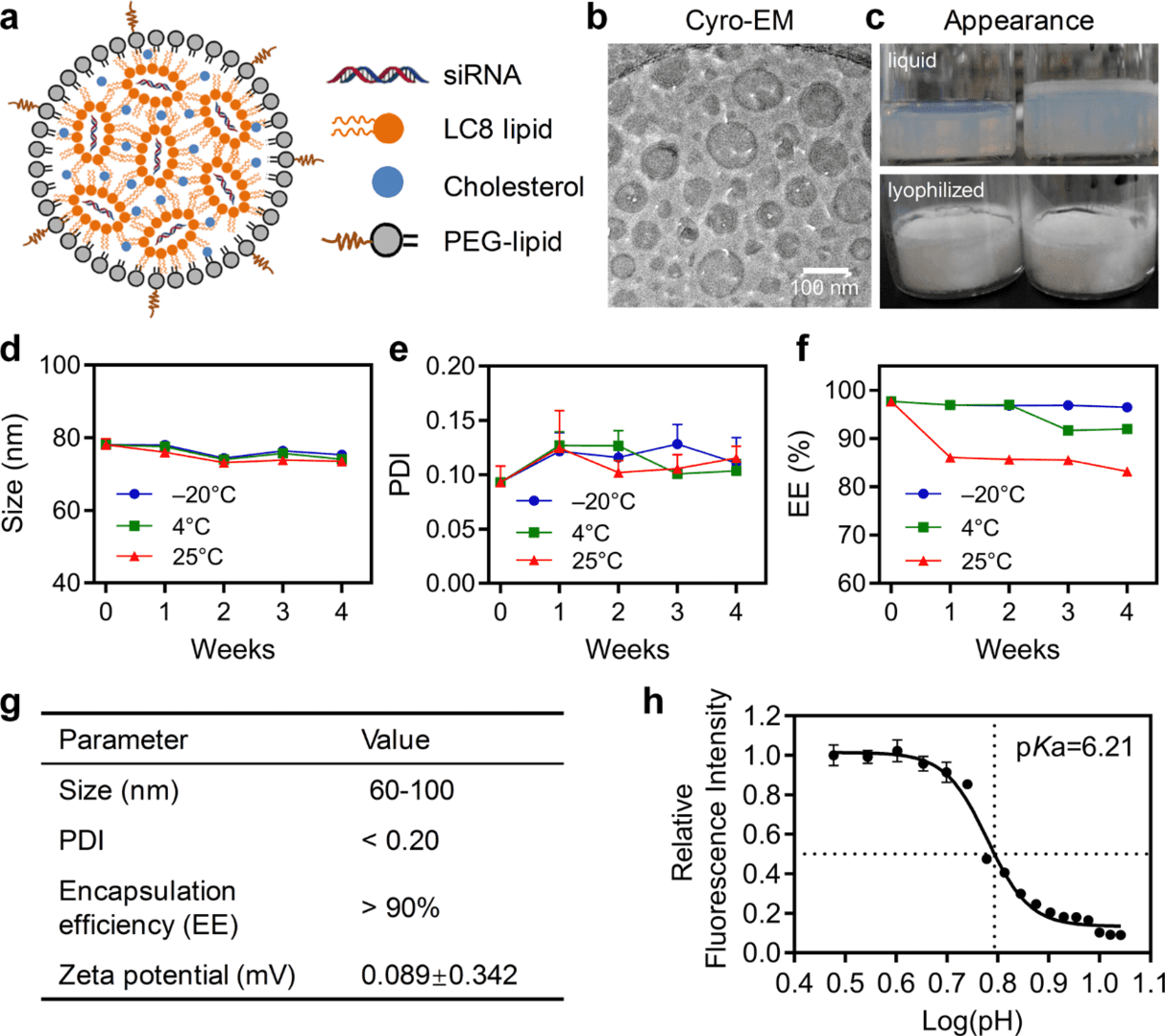 图1. RBP131/siRNA 纳米颗粒的特性。
图1. RBP131/siRNA 纳米颗粒的特性。
已经证明,脂质纳米颗粒(LNP)中存在的可电离氨基脂质的表观酸解离常数(pKa)是决定 LNP 将 siRNA 递送到靶细胞中以在体内引发基因沉默的能力的关键因素。pKas 范围在 6.0 和 6.5 之间的可电离阳离子脂质可以在低 pH 值下有效地配制核酸,并在 pH 值 7.4 下保持中性或低阳离子表面电荷密度。因此,由可电离脂质组成的 LNPs 在循环中显示出最小的正电荷,这可以减少对质膜的破坏。然而,它们将在内体和溶酶体的酸性环境中会被电离,这将激活 LNP 的膜不稳定特性并促使 siRNA 从内体和溶酶体中逃逸。该研究中使用的脂质是经过合理设计的,TNS 测定显示 RBP131 的 pKa 为 ~ 6.21,完全符合 pKa 标准(图 1h)。
为了评估 RBP131/siRNA 再体内介导基因沉默的剂量反应效应,将 siApoB 用 RBP131 封装并以 1、0.5、0.25、0.1、0.05 和 0.01 mg/kg 的剂量静脉注射到 C57BL/6 中(图 2a)。注射后 72h,采集肝脏组织并通过 RT-qPCR 测定 apoB 的 mRNA 表达水平。数据显示,apoB 的表达受到剂量依赖性抑制。当 siRNA 的剂量高于 0.5 mg/kg 时,可实现高于 90% 的敲低效率(图 2b)。使用 GraphPad Prism 软件计算的 ED 50 低至 0.05 mg/kg(图 2c)。这证明了 siRNA 被有效地递送到肝细胞中并,且 RNAi 途径也由 RBP131 递送系统启动。与 apoB 的表达模式一致,肝脏中的 TG(甘油三酯)和 CHO(胆固醇)也呈剂量依赖性升高(图 2d,2e),并且它们在循环中的水平显著降低(图 2f,2g)。此外,对用从动物分离的肝组织制备的肝冷冻切片染色表明,脂质在肝脏中显著积累。应用更高剂量的 siRNA,肝切片中呈现更多脂质(图 2h)。
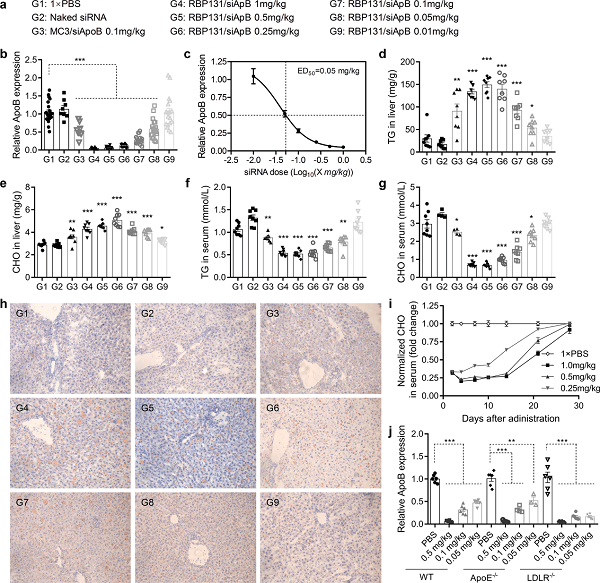 图2. RBP131/siApoB 纳米颗粒的体内沉默性能和机制探索。
图2. RBP131/siApoB 纳米颗粒的体内沉默性能和机制探索。
先前的研究报告称,载脂蛋白 E(apolipoprotein E, apoE)在生理性脂蛋白的清除和肝细胞摄取中起关键作用,可能作为可电离脂质纳米颗粒(ionizable lipid nanoparticles, iLNPs)的内源性靶向配体,而不是阳离子脂质纳米颗粒(cationic lipid nanoparticles, cLNPs)。低密度脂蛋白受体(LDLR)是体内 apoE 的主要肝脏受体之一,它也可能在介导肝细胞摄取 iLNPs 而非 cLNPs 方面发挥重要作用。因此,该研究使用 apoE 基因敲除(apoE-/-)小鼠和 LDLR 基因敲除(LDLR-/-)小鼠研究了 apoE 和 LDLR 对 RBP131 介导的体内 siRNA 递送的影响。结果表明,在 0.5、0.1 和 0.05 mg/kg 的 RBP131/siApoB 剂量下,ApoB mRNA 的表达在所有三个小鼠品系中都被明显抑制,这表明 RBP131 的疗效与 apoE 和 LDLR 都无关(图 2j)。
在这项研究中,选择了一种靶向 HBV 基因多个转录本的 siRNA,称为 SR16-X2M2 或 siHBV(图 3)。采用 psiCHECK™ 双荧光素酶报告系统评估未修饰的 siRNA(SR16-X2)和化学修饰的版本(SR16-X2M2)的靶向和非靶向效应(图 3a - 3h)。据观察,未修饰的 SR16-X2 和化学修饰的 SR16-X2M2 的 IC50 分别为 0.0007 和 0.0115 nM(图 3a,3e)。在相对较高的剂量下(>0.3906 nM),"PS-CM_SR16-X2"有中等的沉默活性(图 3b),表明如果某些转录本与客体链完全互补,SR16-X2 的有义链显示出中等的沉默活性。此外,"GS-SM_SR16-X2"也表现出轻微的沉默活性(图 3c),这意味着如果目标序列与引导链的种子区互补,SR16-X2 的反义链可能会抑制目标表达。然而,对于 SR16-X2M2,没有观察到这些不希望的荧光素酶活性的下调(图 3f,3g)。该结果有力地证明了潜在的脱靶沉默活性,尽管它只发生在高转染浓度下,但通过合理地在 siRNA 的有义和反义链上进行化学修饰,可以完全消除。
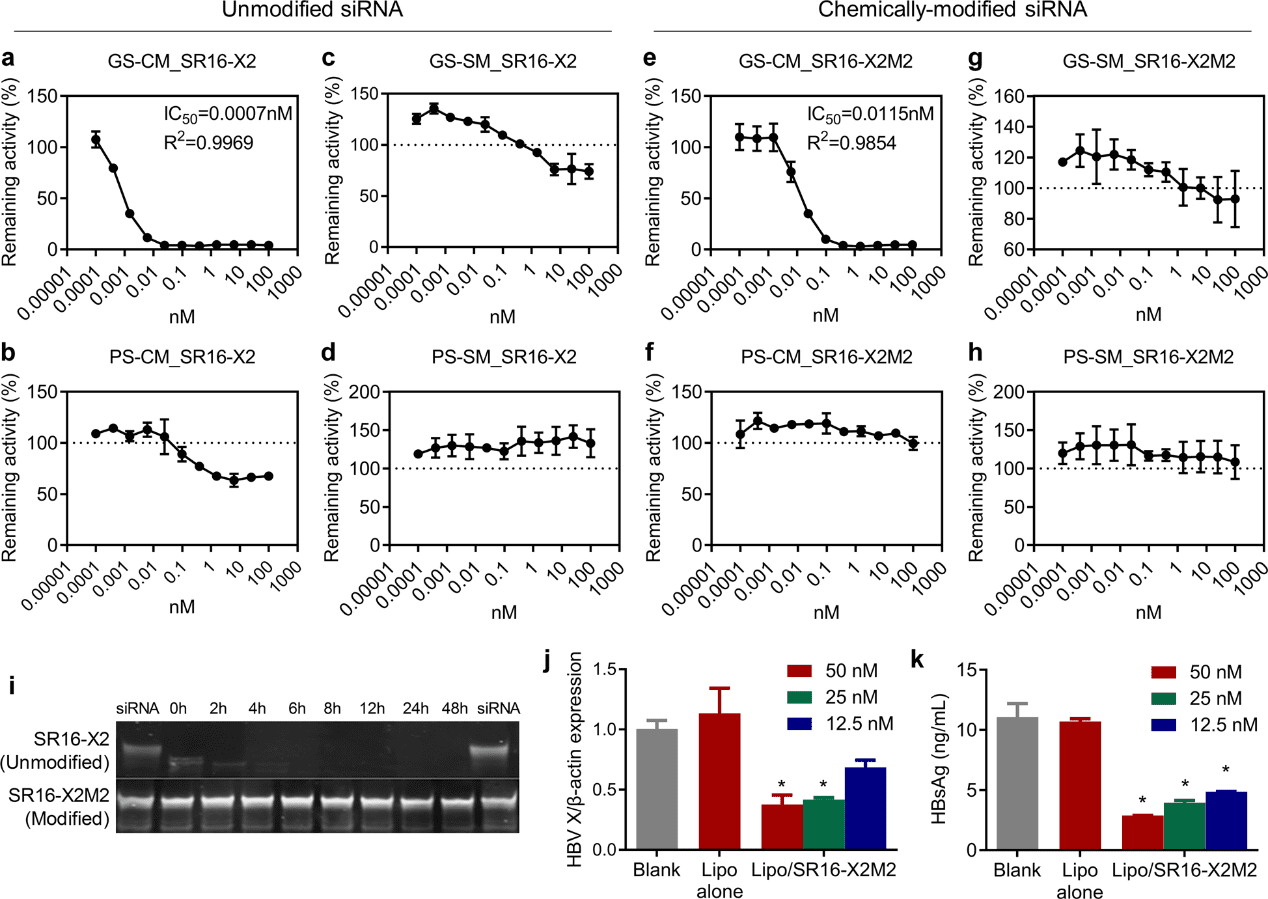 图3. 抗乙肝病毒的 siRNA 在体外的表现。
图3. 抗乙肝病毒的 siRNA 在体外的表现。
采用 HBV 转基因小鼠模型 C57BL/6J-M-Tg(HBV C1.0)评估了 RB-HBV008 的抗 HBV 活性。该模型中,一个单拷贝(3.2 kb)的线性化 HBV 基因组(C1 型)被整合到小鼠第 9 号染色体的一个未知基因 AI604832 的第二外显子中。HBsAg 在血清、肝脏和肾脏中呈阳性表达,HBcAg 在肝脏和肾脏中也可被阳性检测,而 HBsAb、HBeAg、HBeAb、HBcAb 和 HBV DNA 在循环中都呈阴性表达。它不能产生 HBV 病毒颗粒。用这个模型进行了三项研究。首先,将信号剂量的 RB-HBV008 分别以 0.1、0.3 和 1.0 mg/kg 的剂量静脉注射到小鼠体内(图 4a-4c)。RBP131/siNC 和 PBS 作为阴性对照。每周收集血样,并在第 28 天(给药后 4 周)终止测定(图 4a)。数据显示,在接受 RB-HBV008 治疗的动物中,循环中的 HBV 的 S 抗原(HBsAg)水平受到显著抑制。剂量为 1.0mg/kg 的动物实现了超过 2 个对数的减少,并且这种抑制作用很好地保持了 4 周,因为与 PBS 组相比,第 28 天的 HBsAg 水平仍然减少了 0.26 对数(44.5%)(图 4b)。此外,HBsAg 在肝脏组织中的表达也受到剂量依赖性的抑制(图 4c)。
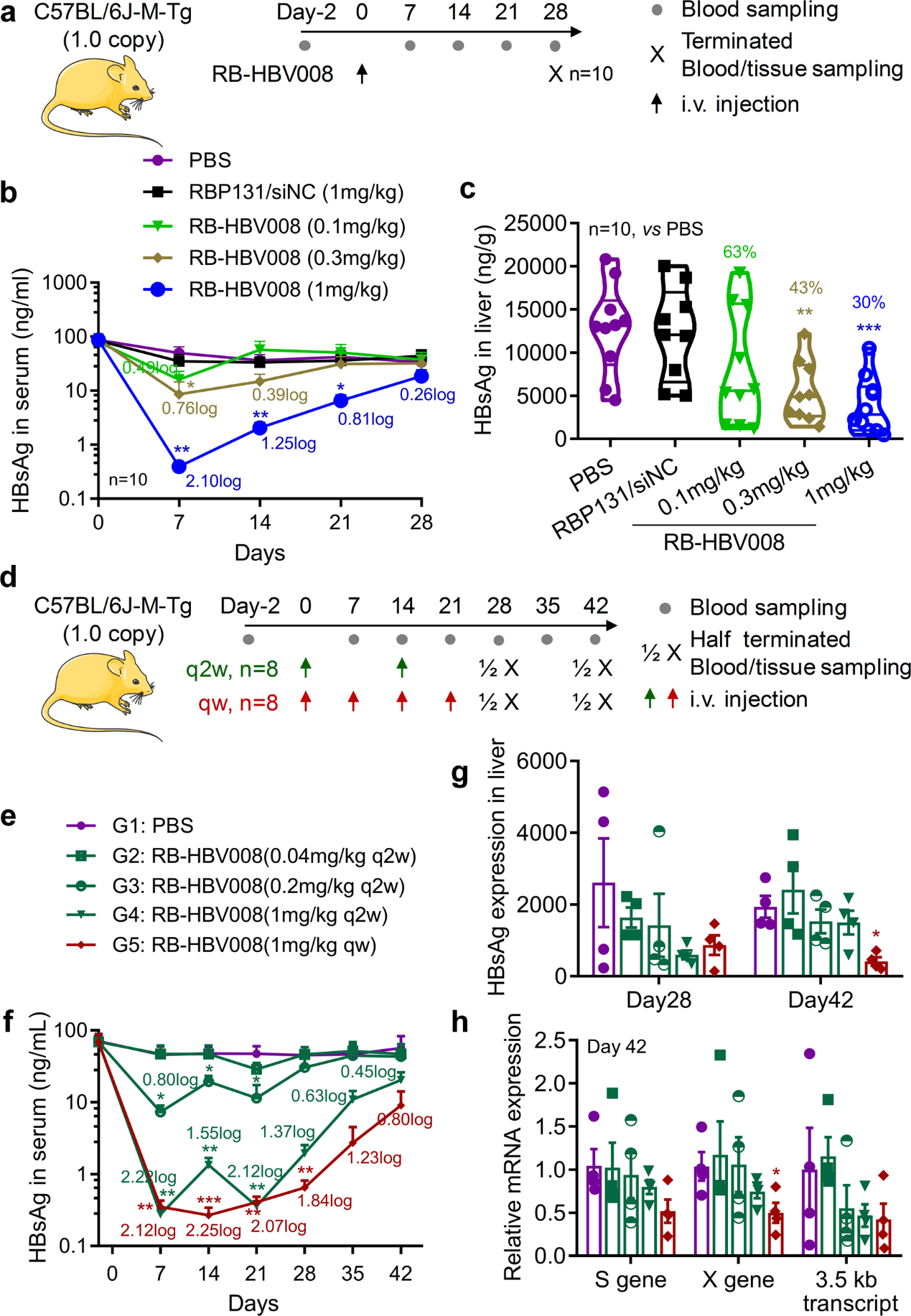 图4. RB-HBV008 在 C57BL/6J-M-Tg(HBV C1.0)小鼠模型中的疗效。
图4. RB-HBV008 在 C57BL/6J-M-Tg(HBV C1.0)小鼠模型中的疗效。
其次,每周(共四剂)或每两周(共两剂)将 RB-HBV008 注射到小鼠体内(图 4d - 4h)。对于每两周给药一次的小鼠,siRNA 的给药剂量分别为 0.04、0.2 和 1.0 mg/kg。对于每周给药组,siRNA 的给药剂量为 1.0 mg/kg。观察到血清中的 HBsAg 呈剂量依赖性和时间依赖性显著下调(图 4d - 4f)。 对于每两周处理一次的小鼠,在给药后第 7 天可以实现超过 99% 的敲低。从最后一次用药起四周后,HBsAg 表达的抑制效率维持在 64%(图 4e,4f)。此外,在每周给药过程中,HBsAg 水平下调超过 99%,从最后一次给药的三周后,可以观察到 84% 的抑制效率(图 4e,4f)。第 28 天和第 42 天肝组织中的 HBsAg 表达也呈剂量依赖性下调(图 4g)。此外,数据显示病毒 RNA 的表达,包括 X 基因、S 基因和 3.5 kb 转录物在第 42 天呈剂量依赖性抑制(图 4h)。在最后一次给药后三周,即第 42 天以 1 mg/kg 给药的小鼠组观察到大约 50% 的基因沉默。因此,RBP131 装载的 ant-HBV siRNA 以剂量和时间双重依赖性方式显著抑制 HBsAg 和病毒 mRNAs 的表达。
为进一步评估 RB-HBV008 的抗病毒活性,使用了另一种 HBV 动物模型(图 5a)。该模型被称为“pAAV-HBV”,是通过注射含有 1.3 倍超长 HBV 基因组的 pAAV-HBV1.3 质粒(10 μg/小鼠)建立的。该模型表达 HBV 病毒的所有元素,包括 HBsAg、HBeAg、HBV DNA 等,但它对 HBV 生命周期仍有一些限制,例如 HBeAg 水平低和缺乏 cccDNA。数据表明,单次给药 0.3、1 和 3 mg/kg 的 RB-HBV008 可对 HBsAg 表达产生强烈且剂量依赖性的抑制作用,分别为 46.9%、91.6%、99.3% 的敲低。对于分别以 1 和 3 mg/kg 给药的组,第 28 天的抑制效率分别保持在 28.0% 和 56.9%(图 5b、5c)。
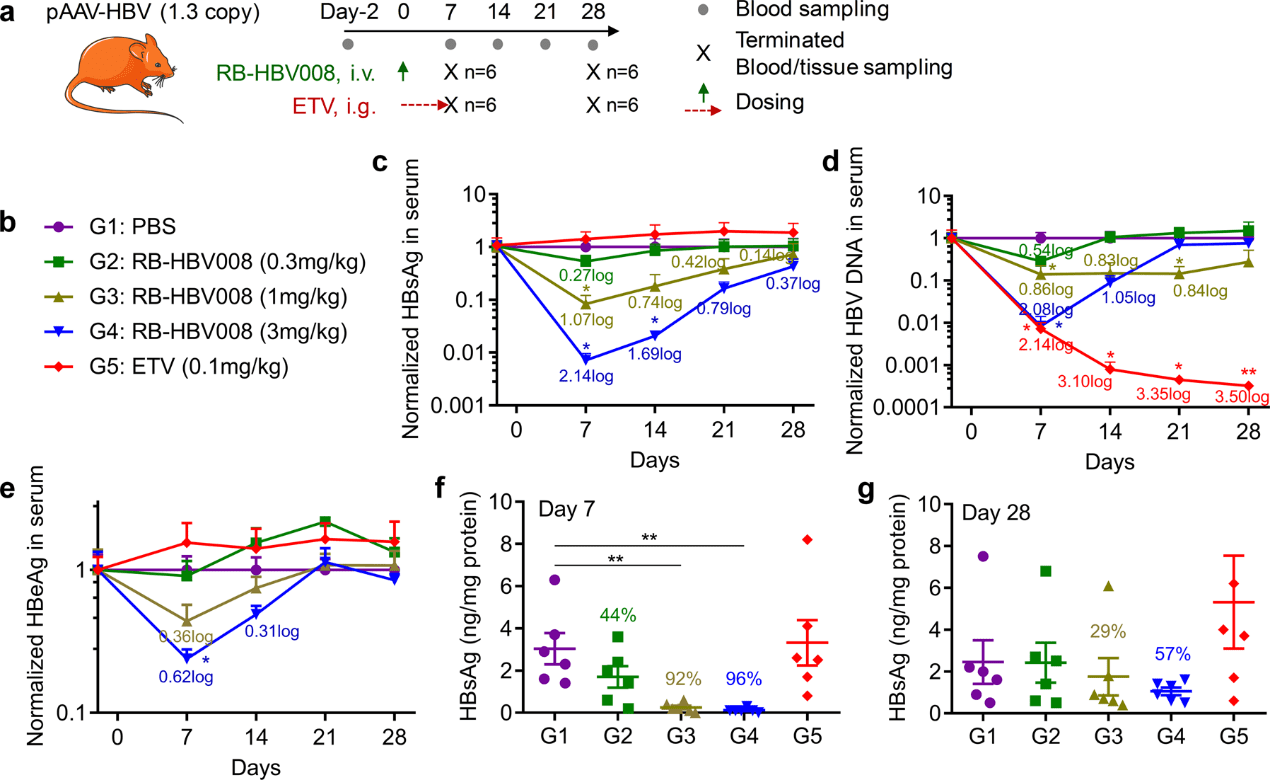 图5. RB-HBV008 对 pAAV-HBV 小鼠模型的疗效。
图5. RB-HBV008 对 pAAV-HBV 小鼠模型的疗效。
恩替卡韦(ETV)是一种用于治疗 HBV 感染的一线抗病毒药物,通过降低繁殖和感染新细胞的能力来减少血液中 HBV 的含量。但使用 ETV 只能实现有限、甚至无法减少 HBV 的抗原蛋白。与预期一致,它未能在实验过程中触发 HBsAg 降低(图 5c)。然而,ETV 显著下调了 HBV DNA,甚至在第 21 天和第 28 天达到了最低检测限(图 5d)。同时, RBP131 装载的 anti-HBV siRNA 也导致 HBV DNA 呈剂量依赖性降低(图 5e)。在给药后第 7 天和第 28 天,肝脏中 HBsAg 的表达也被显著抑制(图 5f,5g)。综上所述,RB-HBV008 不仅能显著抑制 HBsAg 的表达,还能阻断 HBeAg 的合成和 DNA 复制。这些数据表明,siRNA 作为一种潜在的 "功能性治愈"剂,通过单独应用或与 ETV(或其他核苷酸类似物)联合应用,构成了一种新颖而强大的 HBV 治疗策略。
除了疗效之外,RNA 疗法的临床应用还需要有良好的安全性。因此研究人员对小鼠和大鼠进行了复杂的安全性评估。首先,对 RBP131/siRNA 纳米颗粒进行了单剂量毒性研究,然后对雄性 CD-1 小鼠进行了 1、3 和 5 mg/kg siRNA 给药剂量的血清细胞因子组、肝脏血液化学和组织病理学研究(图 6)。细胞因子诱导实验(图 6a - 6k)显示,与 1 × PBS 处理的小鼠相比,接受 3 和 5mg/kg RBP131/siRNA 的小鼠在 3h 时 IL-5、KC(CXCL1)和 MCP-1 的表达有短暂的增加,这种增加在 24h 内恢复到基线(图 6f,6g,6k)。然而,LPS 在注射后 3h 诱导许多细胞因子显著增加,例如 TNF-α、IFN-γ、KC、MCP-1、GM-CSF、IL-6 和 IL-12。LPS 还引发了体重的显著降低和脾脏器官系数的增强。Poly I: C 在注射后 3h 诱导 IL-12 显著升高(图 6d)。此外,还分析了与 RBP131/siRNA 处理的小鼠的天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、CREA(血清肌酐)、BUN(血尿素氮)的血清化学成分(图 6l - 6p)。总之,这项初步的单剂量毒性研究支持:小鼠对这些剂量下的 RBP131/siRNA 纳米颗粒耐受性良好。
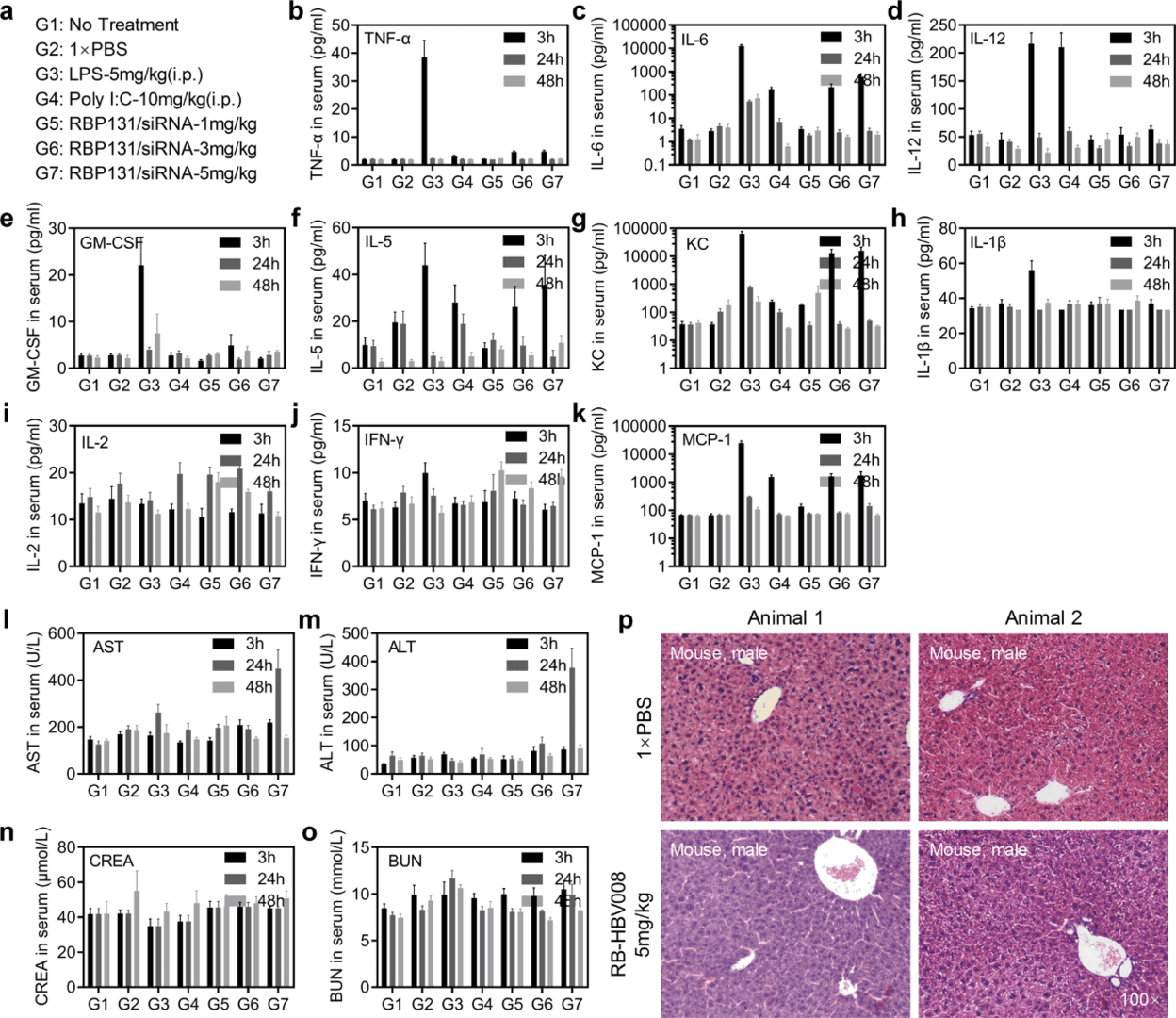 图6. RB-HBV008在小鼠中的毒性评价。
图6. RB-HBV008在小鼠中的毒性评价。
目前的治疗药物可以很好地控制病毒 DNA 的复制,但它们不能有效地降低抗原蛋白的表达。在乙型肝炎患者中,抗原蛋白介导免疫耐受并导致 T 细胞过度消耗。RNAi 疗法可以机械地抑制所有病毒基因转录本的表达,不仅可以减少病毒 DNA 的复制,还可以显著抑制抗原蛋白的表达,因此有望在临床治疗中实现功能性治愈。在该研究中,开发了一种名为 LC8 的新型可电离类脂质材料,用以克服 RNAi 药物开发中最具挑战性的递送障碍问题。在瞬时和转基因小鼠模型中的功效研究表明,在循环和肝组织中,病毒 RNA 和抗原以及病毒 DNA 的表达呈剂量依赖性和时间依赖性抑制。在此基础上,在多种疾病的小鼠模型和大鼠中对 HBV 治疗性 RNAi 制剂进行了深入的临床前研究,突出了其在下一阶段 HBV 功能性治愈中的良好发展前景。
原文链接:
https://www.nature.com/articles/s41392-021-00859-y
安必奇生物提供独特的 Hi-Affi™ siRNA 转染试剂,是一种由天然化合物衍生的新型合成分子,其具有高效的转染水平和最小的脱靶效应。该试剂在贴壁细胞和悬浮细胞中均可实现高质量的基因沉默,并且其反向转染方案也可用于高通量研究中,适用于多种类型细胞。欢迎免费咨询!
24小时服务在线

