随着新型非病毒递送方法的进步,使用 mRNA 作为治疗应用的载体变得更加实用。与 DNA 转染或病毒载体转导相比,mRNA 为药物开发人员提供了一个高效、易于设计且更安全的基因转移平台。此外,mRNA 递送为基因治疗提供了实现瞬时治疗的潜力,且没有插入突变的风险。目前有几种方法可用于在人原代造血细胞(如淋巴细胞)的体外 mRNA 转染,临床标准是电穿孔法。用短暂的高压电脉冲在细胞膜上产生瞬时孔隙,从而实现转染,但电脉冲引起的细胞膜的永久通透会导致大量的细胞死亡,损害细胞的活力。而使用电场进行转染会导致高毒性和低细胞活力,很难通过这种转染模式扩大应用规模。此外,基于化学的转染虽然是病毒载体和电穿孔的典型替代方法,但在转染原代细胞(包括自然杀伤细胞和 T 细胞)方面表现不佳。脂质体转染,例如,由于 T 细胞对标准的化学试剂有抵抗力,脂质体转染的效率极低。

2021 年 11月 1日,CellFE 公司的研究人员在 Scientific Reports 杂志上发表了题为“使用超快速物理变形将 mRNA 微流体转染到人原代淋巴细胞和造血干细胞和祖细胞中”的研究论文。该研究设计了一种新型微流体装置,允许通过体积交换对流转染(volume exchange for convective transfection, VECT)进行有效的 mRNA 递送。在该装置中,细胞流过脊状通道,该通道强制执行一系列超快速和大强度变形,能够瞬时打开孔并诱导 mRNA 对流运输到细胞中。对自然杀伤(NK)细胞、造血干细胞和祖细胞(HSPCs)的实验表明,该设备可以在广泛的细胞和有效载荷浓度下运行,并且不会对 T 细胞功能产生负面影响。

该研究设计并制造了一种能够通过 VECT 将 mRNA 有效载荷传递到人原代细胞中的装置,其结构如下图所示。在该设备中,当含有细胞和有效载荷的原生培养基悬浮液流经该通道时,包含五个 V 形脊的微流体通道(图1a,1b)能够在极短时间内(< 1 ms)突然压缩细胞。在 COMSOL 中进行模拟时,预测了设备内的层流模式行为,其特征是每个脊收缩处的流速突然急剧变化(图1c)。为了在保持细胞活力的同时实现高 mRNA 转染效率,优化了脊下空间的流速和间隙大小。
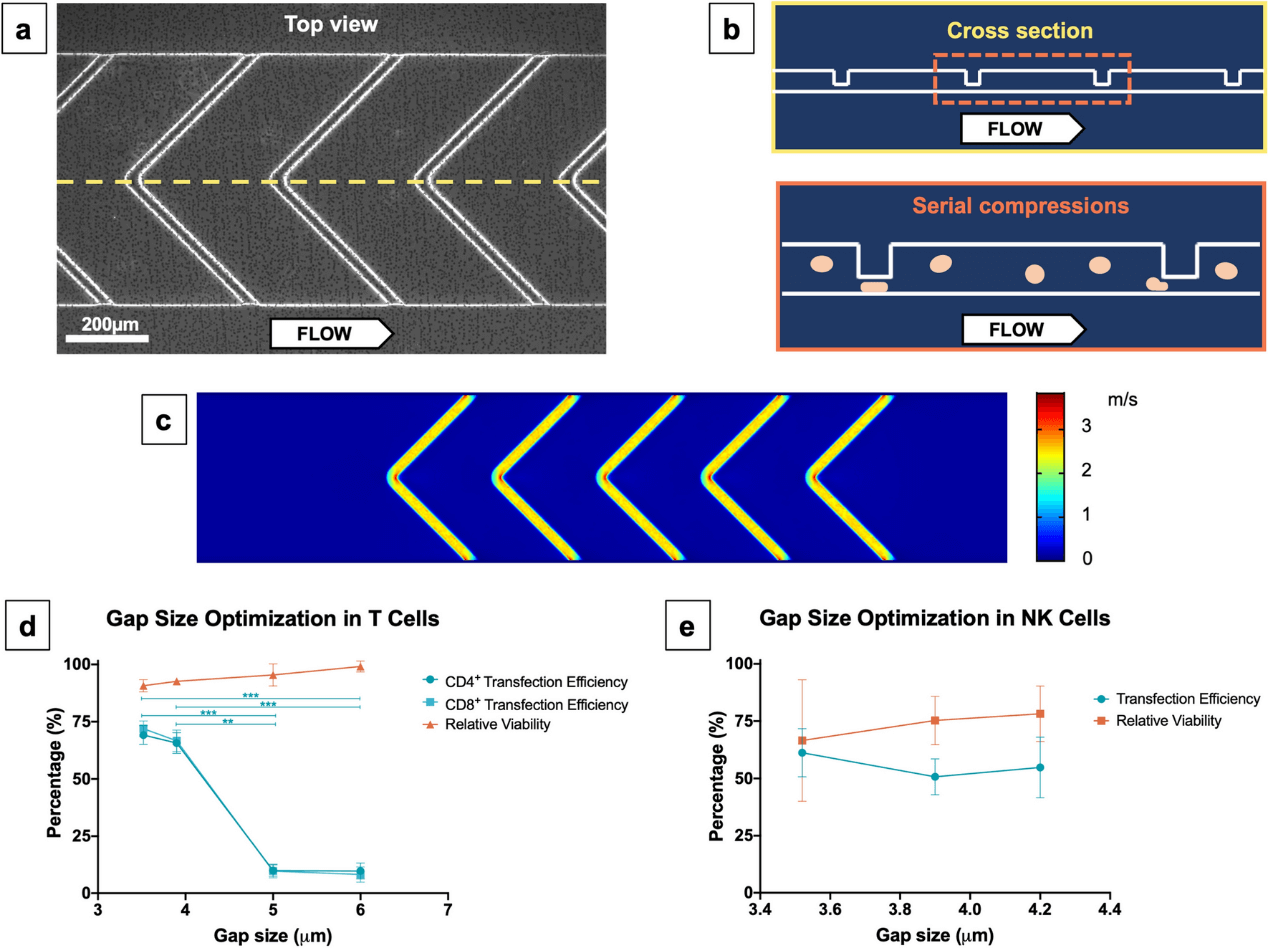 图1. 用于人类原代细胞 VECT 的微流体装置的优化。
图1. 用于人类原代细胞 VECT 的微流体装置的优化。
潜在地减少转染所需的 mRNA 量,以及增加在设备内流动的操作细胞浓度,是使转染过程的成本效益最大化的补充方法。对于 T 细胞来说,当 mRNA 浓度从 160 µg/ml 降至 40 µg/ml 时,转染效率保持不变(图2a)。当使用 70 µg/ml 的恒定 mRNA 浓度时,将操作 T 细胞浓度从 2 × 106 增加到 1.2 × 107 个细胞/ml,使 CD4 +和 CD8 + 细胞的转染效率至少达到 60%(图2b)。结果表明,在测试的细胞浓度较低范围( 2×106 个细胞/ ml 和 4×106 个细胞/ml)和测试的最大浓度 1.2×107 个细胞//ml 之间,CD4+ 转染的细胞数明显提高。在NK细胞中,通过采用 80 至 20 µg/ml 的 mRNA,探究了 mRNA 浓度对 VECT 的影响(图2c)。结果表明,转染效率和细胞活力的趋势在 40 µg/ml 的 mRNA 时达到峰值。需要对 NK 和 T 细胞的应用进行进一步研究,以探究成功转染所需的最低 mRNA 浓度,以及该系统在细胞浓度方面的最大处理能力。
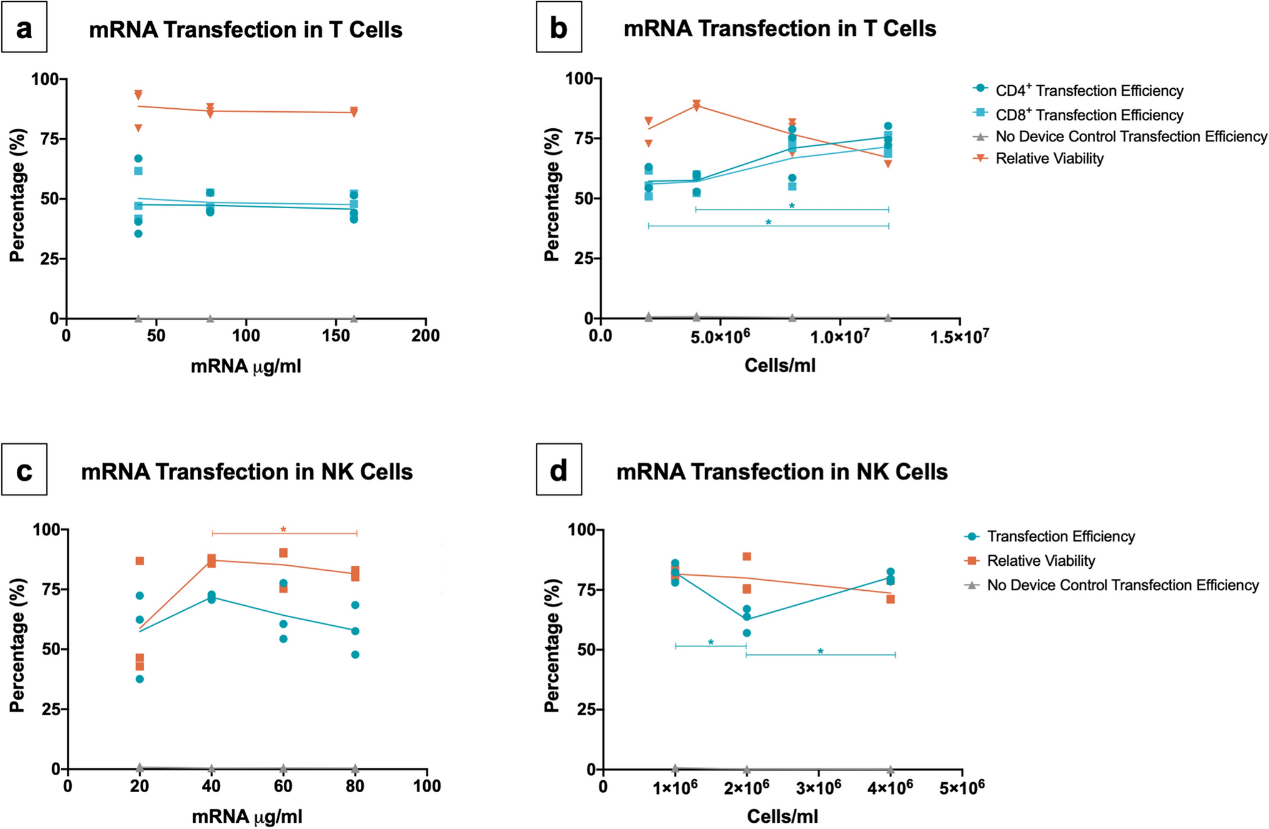 图2. 采用 VECT 微流控设备对 T 细胞和 NK 细胞进行 mRNA 转染的操作范围。
图2. 采用 VECT 微流控设备对 T 细胞和 NK 细胞进行 mRNA 转染的操作范围。
在转染时保留细胞功能对于离体基因疗法(如 T 细胞衍生产品)的有效性至关重要。为了解 VECT 是否影响正常 T 细胞功能,研究人员将用 VECT 转染的细胞的扩增、细胞因子释放、衰竭和分化情况与未经历压缩的细胞(即阴性对照)的情况进行比较。结果显示,在 VECT 转染后,原代 T 细胞的功能大多得到了保留。在 VECT 和阴性对照之间没有观察到倍数扩张的差异(图3a),在激活后的 15 天内,细胞数量达到了约 25 倍的增长,表明细胞在用微流控设备处理后可以正常增殖。当 VECT 后 24 h 重新激活转染的细胞,并在 48 h 内测量细胞因子的表达,除了在三个 VECT 设备中的一个检测到 IFNγ 的分泌显著增加,没有观察到这些细胞因子的明显差异(图3b)。此外,细胞耗竭情况、T 细胞分化情况均无显著差异(图3c,3d)。
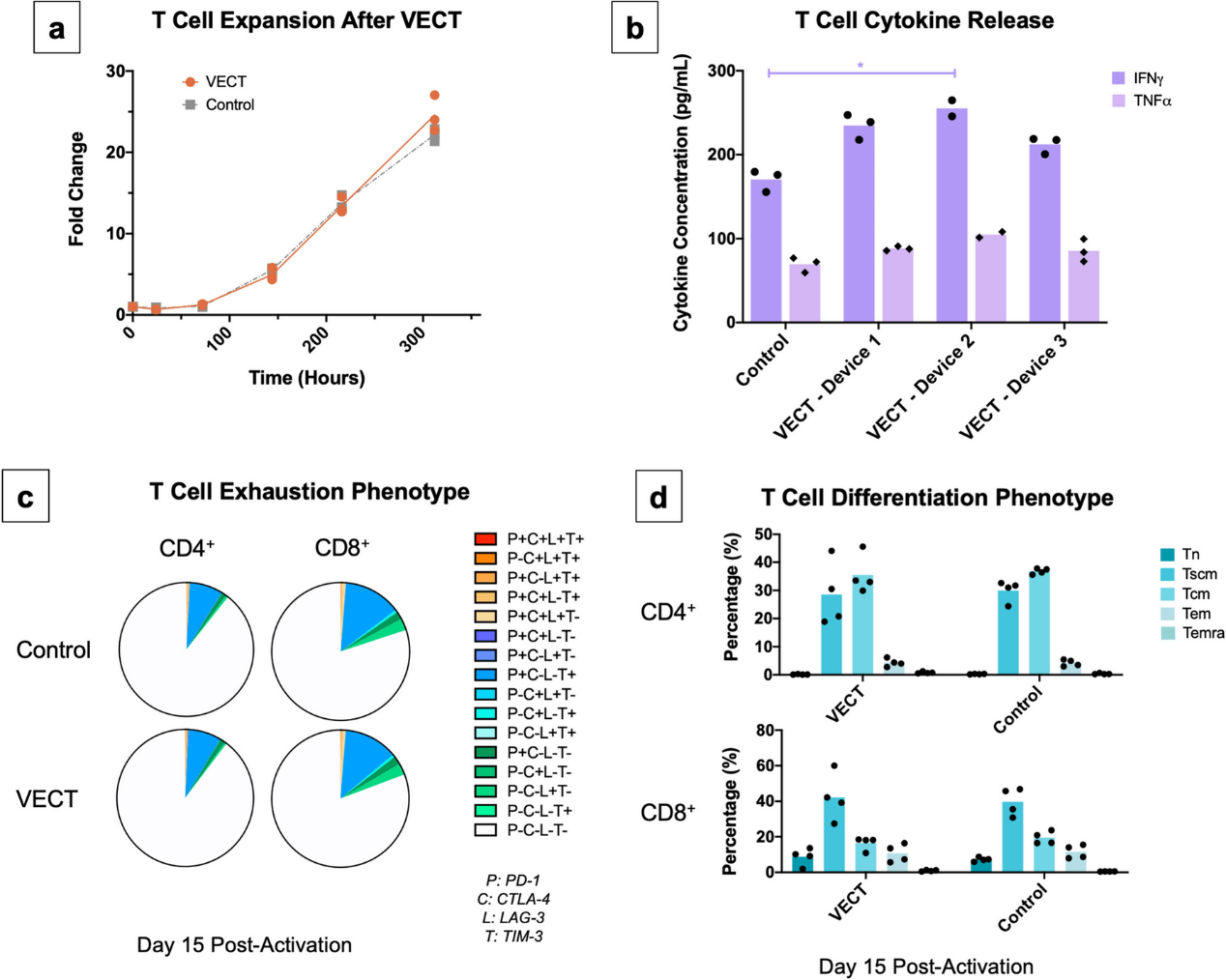 图3. 在 VECT 上保留细胞功能。
图3. 在 VECT 上保留细胞功能。
目前使用 VECT 进行 T 细胞和 NK 细胞转染的最佳条件如图 4 所示。转染过程的性能通过测量这三种具有治疗意义的细胞类型的相对活力、回收率、转染效率和产品产量来表征。结果表明,VECT mRNA 转染的最佳条件在 T 细胞、NK 细胞和动员的外周血 CD34+ 造血干细胞和祖细胞(HSPCs)之间有些不同,可能反映了这些细胞类型生物力学特性上的关键差异。数据证明 mRNA 成功转染到原代T细胞(图4a)和NK细胞(图4b)中。在 T 细胞中,VECT 导致的的相对活力和回收率(~ 75%)都很高,mRNA 转染效率达到约 80%,CD4+ 和 CD8+ T 细胞的产物产量约为 70% 。对于 NK 细胞,VECT 导致更高的相对活力和回收率(> 80%),但转染效率(~ 60%) 和产物产量(~ 50%)低于 T 细胞。
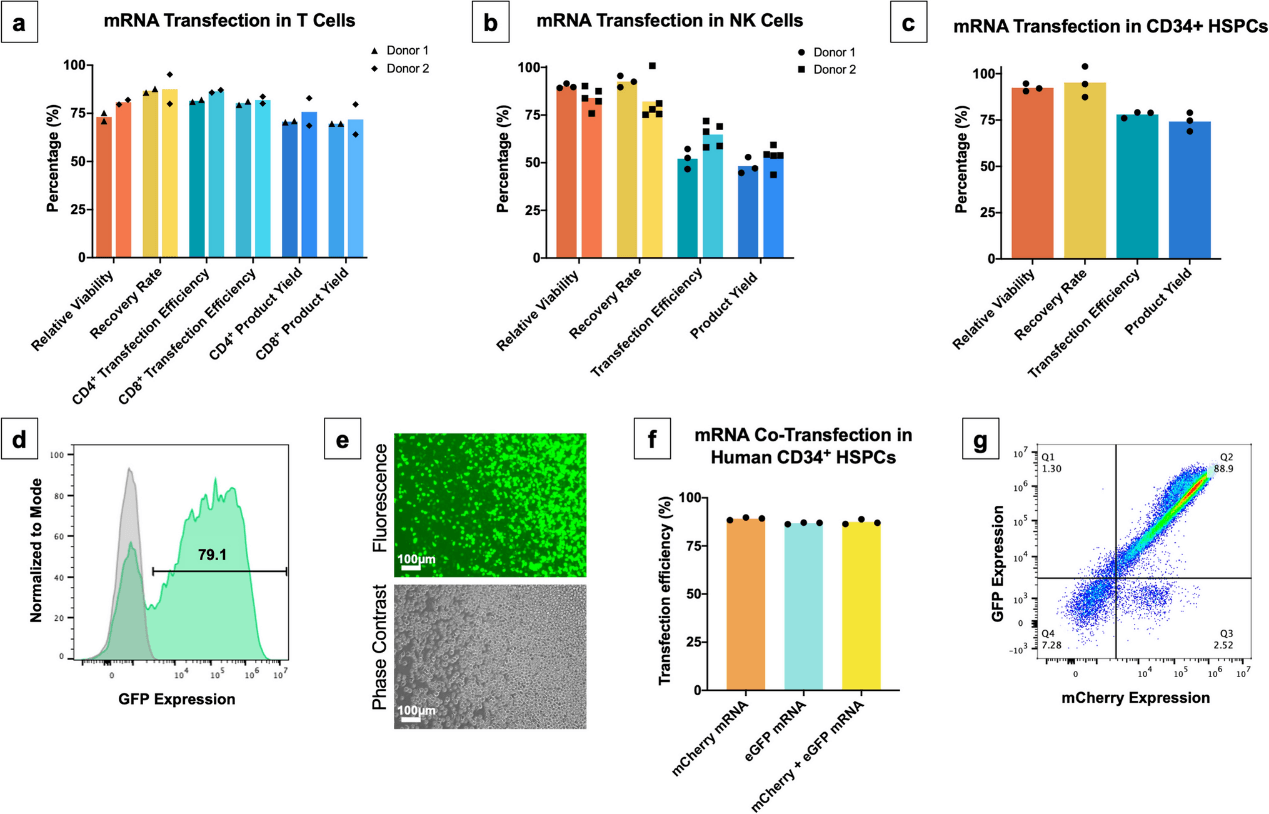 图4. T细胞、NK细胞和 HSPCs 的优化 mRNA 转染结果;通过相对活力、恢复率、转染效率和产品产量进行评估。
图4. T细胞、NK细胞和 HSPCs 的优化 mRNA 转染结果;通过相对活力、恢复率、转染效率和产品产量进行评估。
在对 HSPCs 进行 VECT 时,观察到微流控装置能够保持较高的相对活力和回收率(> 90%),同时实现较高的转染效率(约75%)和总产物产量(> 70%)(图4c)。HSPCs 的转染效率是通过流式细胞仪分析下出现的 GFP 阳性细胞来衡量的(图4d),并在荧光显微镜下进行目测确认(图4e)。此外,mRNA 转染的一些治疗应用,例如使用 ZFN 或 TALEN 进行基因编辑,需要在靶细胞中同时共表达两种不同的蛋白质。为了证明该装置共同递送两个独立 mRNA 分子的能力,研究人员分别测量了编码 mCherry 和 eGFP 蛋白的两种不同 mRNA 分子的转染效率。单独的 mCherry mRNA、单独的 eGFP mRNA 以及两种 mRNA 分子的共同递送的转染效率都很高(> 85%),并且在所有三种条件下都一致(图 4f)。当通过流式细胞术分析时,共转染显示了 mCherry 和 eGFP 表达之间的紧密线性相关性(图4g)。
与广泛的基于 DNA 的方法相比,mRNA 转染提供了一个更简单、基因毒性更低和更快速的转基因表达平台。该研究证明了一种新型微流体装置能够通过体积交换对流转染(VECT)将 mRNA 成功转染到人类原代 T 细胞、NK 细胞和 CD34+ HSPCs 中。且 VECT 后的 T 细胞功能,细胞扩增和耗竭方面,并未显示出不利影响。目前的工作表明,VECT 微流体装置可广泛用于基于 mRNA 的离体应用和细胞载体。接下来的研究方向是证明改装置的可扩展性,以实现临床规模的转染,实现高生产率制造数以亿计的 mRNA 转染的 T 细胞和 NK 细胞。
原文链接:https://www.nature.com/articles/s41598-021-00893-4
安必奇生物致力于为国内外客户提供 MicroRNA Agomir/ Antagomir 递送系统研究和分析相关服务。代理技术团队拥有多年的运载体定制经验,能在较短的时间内为客户提供理想的载体筛选和制备服务。另外,还完善了一整套 miRNA的合成及纯化技术,能够提供优质的 miRNA 合成产品,促进客户相关项目的快速进展。欢迎免费咨询!
24小时服务在线

