由严重急性呼吸系统综合征冠状病毒 2(SARS-CoV-2)引起的 2019 冠状病毒病(COVID-19)已成为历史上最致命的大流行疾病之一。SARS-CoV-2 不仅会感染呼吸道,还会对肾脏、肝脏、心脏等许多器官造成损害。类器官可以自我更新并重现不同器官的各种生理机能,是模拟 COVID-19 的强大平台。在这篇文章中,我们概述了当前应用人类多能干细胞衍生的类器官和成体类器官来研究 SARS-CoV-2 趋向性、宿主反应和免疫细胞介导的宿主损伤,以及进行药物发现和疫苗开发的努力。
类器官模型是小型化的体外器官模型,由干细胞或从病人身上提取的成人组织在特定的三维(3D)微环境中产生。它们可以自我组织并分化成为功能性细胞类型,高度模拟体内器官的特征。分析器官的形成可以加深对人类发育和组织/器官再生机制的理解。此外,类器官也为疾病建模和药物发现提供了强大的平台。类器官的起源可以追溯到 1907 年,当时 H. V. Wilson 试图在体外再生生物体,并表明机械分离的海绵细胞可以重新组装并自组织成具有正常功能的新海绵生物体。在 1965 年的 3D 细胞培养的早期研究中,类器官被定义为异常的细胞生长或细胞内结构。在 1975 年,Rheinwald 和 Green 首次描述了长期培养人体细胞的方法。随着 3D 培养方法的进步,Emerman 和 Pitelka 在 1977 年通过悬浮胶原凝胶培养乳腺上皮细胞,并在表达了一个月的乳蛋白。1981年,首次从小鼠胚胎中分离出胚胎干细胞(embryonic stem cells, ESCs),并于 1998 年实现了人类囊胚的体外培养。
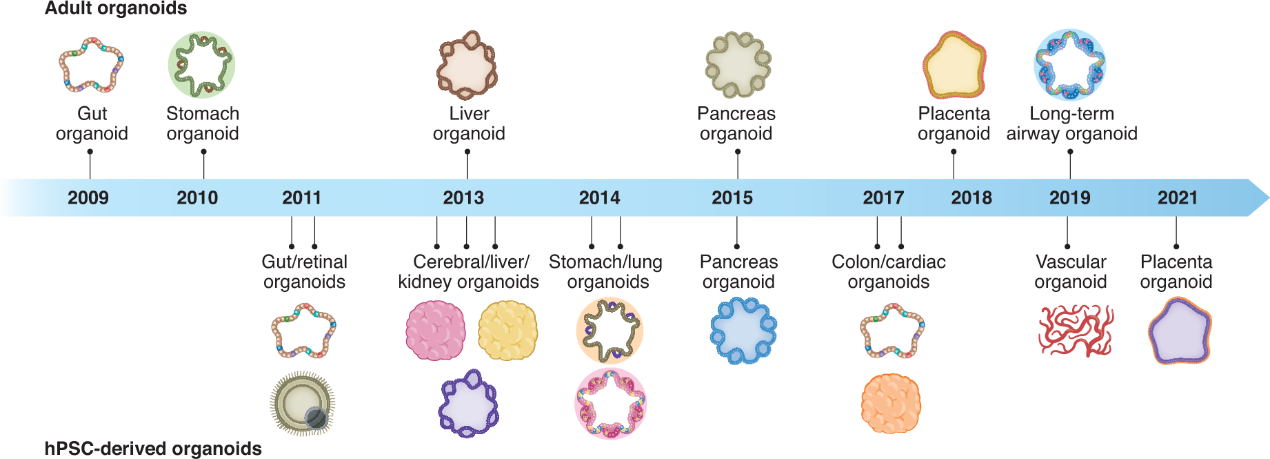 建立不同类器官类型的研究总结。
建立不同类器官类型的研究总结。
2006年,通过引入四个转录因子,从小鼠胚胎或成体成纤维细胞中诱导出多能干细胞(pluripotent stem cells, PSC)。2008年,Eiraku 及其同事利用 3D 聚集培养系统从 ESCs 中生成显示顶基部极性的皮质组织。2009年,Sato 等人证明了富含亮氨酸重复的 G-蛋白偶联受体5(Lgr5)阳性的成体肠道干细胞的存在能够诱导 Matrigel 中形成 3D 结构,这些结构可以在没有非上皮细胞生态位的情况下自我组织并分化成隐窝-绒毛类器官。此后,许多 3D 培养的类器官系统被成功生成,包括从人类多能干细胞中提取的肠道、视网膜、脑、肝、肾、胃、肺、胰腺、结肠、心脏和血管类器官(hPSC 衍生的类器官)和从成人组织中提取的胃、肝、胰腺、胎盘和肺类器官(成体类器官;上图)。
类器官已被应用于模拟人类疾病,包括传染病。这种无动物系统易于使用,并为人类生理学和病理学提供了新的见解。早期研究工作始于寨卡病毒(Zika virus, ZIKV)爆发期间。2016 年,使用大脑类器官(brain organoid, BO)模型,发现 ZIKV 感染神经祖细胞,导致细胞死亡增加和增殖减少。随后,ZIKV 感染的 BOs 被用来研究病毒的趋向性和毒株的致病性,并用于全基因组分析。此外,BOs 被用于化学筛选研究,确定了几种潜在的抗 ZIKV 候选药物。最近的一项研究表明,ZIKV 和 1 型单纯疱疹病毒都会损害 BOs 的生长,诱发明显的形态缺陷和转录变化,并最终导致小头畸形,为该疾病的病理生理学提供了关键的见解。在 COVID-19 大流行之前,多项研究应用人肺类器官来研究呼吸道疾病,例如呼吸道合胞病毒和流感病毒。这些研究激发了该领域应用类器官平台来研究新出现的病毒,如 SARS-CoV-2。
由 SARS-CoV-2 感染引起的 COVID-19,可导致严重的急性呼吸综合征、高炎症反应和广泛的多器官损伤(下图)。COVID-19 的常见症状包括发烧、咳嗽、疲劳、呼吸急促以及失去味觉和嗅觉。许多研究已经报告了 SARS-CoV-2 的进入因素。最早发现且占主导地位的 SARS-CoV-2 受体是存在于多种类型人类细胞表面的血管紧张素转换酶 2(angiotensin-converting enzyme 2, ACE2)。刺突蛋白的切割进一步促进病毒进入细胞,这可以由共受体跨膜丝氨酸蛋白酶 2(transmembrane serine protease 2, TMPRSS2)和组织蛋白酶 L(cathepsin L, CTSL)调节。FURIN 裂解位点在 SARS-CoV-2 进入中也起着重要作用。最近的研究发现,神经蛋白酶-1(neuropilin-1, NRP1)是另一个可以促进 SARS-CoV-2 进入的因素。
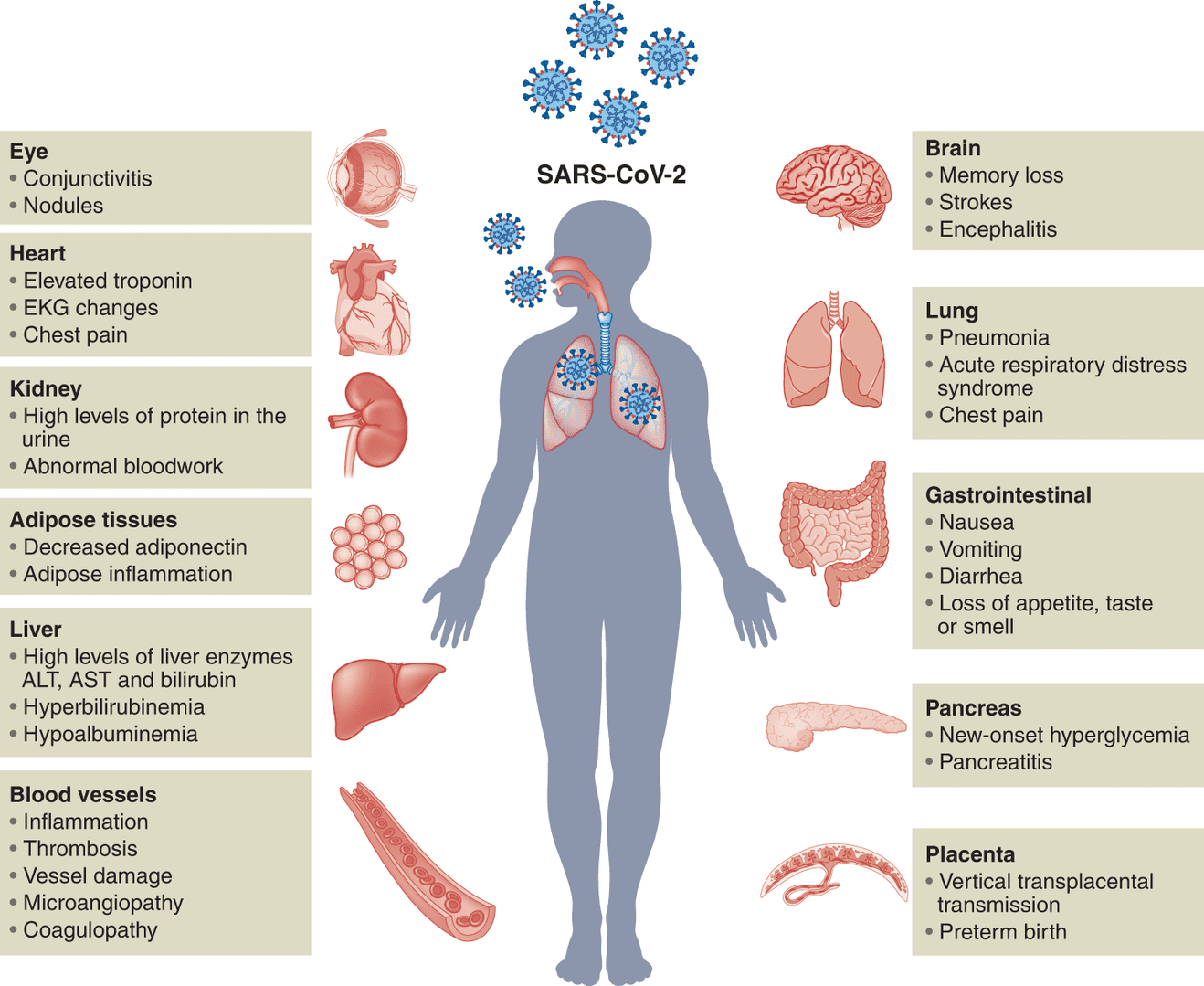 COVID-19 患者不同器官系统的并发症。
COVID-19 患者不同器官系统的并发症。
由于 ACE2 广泛分布于哺乳动物细胞中,SARS-CoV-2 可以通过呼吸道感染人体,并迅速扩散到其他器官系统。因此,COVID-19 不仅会导致严重的呼吸道疾病,还会导致其他器官受损,包括大脑、心脏、肝脏、肾脏、肠道和胰腺等。并发症包括精神、认知或身体障碍、静脉血栓栓塞、心肌炎、心力衰竭、心律失常、心脏骤停、急性肾损伤、肝损伤、高血糖和酮症、急性脑血管疾病等等。几种单层培养系统,例如 Vero E6 细胞或过表达 ACE2 的癌细胞,已被用于 SARS-CoV-2 感染的治疗筛选和机制研究。但是二维(2D)细胞培养模型无法模拟宿主生物的复杂性,并且通常具有与天然组织不同的表型。因此,与人体组织/器官的体内生理和病理特征具有较高相似性的平台,如 3D 类器官,可以作为研究 SARS-CoV-2 感染、模拟受损器官的病理生理学和进行药物发现的先进模型。
呼吸类器官
(一)肺泡类器官
肺泡类器官(Alveolar lung organoids, ALO)包含 1 型和 2 型肺泡上皮细胞(AT1 和 AT2)以及间质细胞。ACE2 主要在 AT2 细胞亚群中表达,而共受体 TMPRSS2 则广泛分布。hPSC 衍生的 ALO 已用于模拟肺泡中的 SARS-CoV-2 感染,表明 AT2 细胞对SARS-CoV-2 感染具有容许性。此外,感染 SARS-CoV-2 的 hPSC-AT2 细胞能够重现宿主免疫反应,导致炎症表型、核因子 κB(NF-κB)信号的诱导和成熟肺泡群体的丧失。hPSC 衍生的 ALO 也已被用于鉴定阻断 SARS-CoV-2 进入或复制的候选药物和抗体。例如,对美国食品和药物管理局(FDA)批准的药物进行的高通量筛选发现了三种阻断 SARS-CoV-2 进入的候选药物。另一项化学筛选确定了在 hPSC 衍生的心肌细胞和 ALO 中降低 ACE2 水平并抑制 SARS-CoV-2 的药物。此外,发现 EK1 肽阻断刺突蛋白和 TMPRSS2 抑制剂可有效阻止病毒进入 hPSC-ALO。最后,发现一种人类中和抗体可抑制 hPSC-ALO 中 SARS-CoV-2 的感染。除了病毒进入,还有几种候选药物被验证可以阻断 SARS-CoV-2 在 hPSC-ALO 中的复制,包括瑞德西韦,这是一类针对 SARS-CoV-2 主要蛋白酶(Mpro)的化合物。功能研究发现一种干扰素刺激基因(ISG)和广泛的病毒抑制剂 25-羟基胆固醇(25HC)可以抑制病毒进入 hPSC-ALO。机制研究发现 25HC 可以激活酰基辅酶A:胆固醇酰基转移酶并诱导质膜中可利用的胆固醇耗尽。
(二)肺气道类器官
hPSC 衍生的气道类器官(airway organoids, AWO)由功能性多纤毛细胞、基底细胞、产生粘液的分泌细胞、分泌 CC10 的棒状细胞等组成。感染 SARS-CoV-2 后,hPSC-AWO 会发生显著的代谢变化,包括脂质代谢的下调和糖酵解的上调。使用 hPSC-AWO 进行的高含量化学筛选发现 GW6471 可以通过抑制缺氧诱导因子 1-α(HIF1α)途径和糖酵解速率来阻断 SARS-CoV-2 感染。还发现了几种脂肪酸生物合成抑制剂,例如黄腐酚和 ND-646,都可阻断 SARS-CoV-2 感染。具有与 hPSC-AWOs 相似细胞成分的成体 AWOs 也支持活跃的病毒复制。因此,成体 AWO 已被用于研究 SARS-CoV-2 变体的复制动态,包括 B.1.1.7、B.1.427、B.1.429 和 B.1.617.2。在活病毒系统中,SARS-CoV-2 变体 B.1.1.7 显示出比原始分离株 Bavpat-1 更高的复制效率,随后的研究表明变体 B.1.617.2 显示出比 B.1.1.7 更高的复制效率。此外,一种人源化诱饵抗体(ACE2-Fc)通过破坏 ACE2 与病毒刺突蛋白的结合来阻断病毒感染,从而阻止进入成体 AWO。
(三)支气管类器官
除了肺 ALOs 和 AWOs,成体支气管类器官(bronchial organoids, BCO)也已被用于 SARS-CoV-2 研究。微阵列分析确定了 SARS-CoV-2 感染后细胞因子/趋化因子的变化。通过比较 SARS-CoV-2 感染的 BCOs 与其他类型细胞的高通量表达矩阵数据,集落刺激因子 3(CSF3)被确定为潜在的药物靶点。另一项研究发现,microRNA hsa-MIR-5004-3p 靶向 SARS 和 SARS-CoV-2 的前导序列,在 BCOs 感染 SARS-CoV-2 后其表达减少。总之,呼吸道类器官模型表明,纤毛细胞、棒状细胞和 AT2 细胞亚群从近端到远端排列在气道和终端肺泡中,可感染 SARS-CoV-2。这些发现与 COVID-19 患者的尸检数据一致,表明呼吸道类器官模型能够重现体内 SARS-CoV-2 感染。
肠道类器官
COVID-19 患者通常表现出胃肠道症状,例如腹泻、呕吐或腹痛,人类肠道类器官(intestinal organoids, IOs)被确定为体外研究肠道病理生理学的生理相关模型。IOs 包含多种细胞类型,包括肠上皮细胞、杯状细胞、肠内分泌细胞、转运增殖细胞和干细胞。hPSC 衍生的和成体 IOs,包括小肠类器官(SIO)、结肠类器官(CO)和回肠类器官(ILO),已被用于研究 SARS-CoV-2 感染。SARS-CoV-2 感染伴随着 hPSC-SIO 的超微结构变化,并诱导出强大的转录反应,包括 ISG。SARS-CoV-2 诱导的类器官恶化,可以通过瑞德西韦来挽救。此外,使用 hPSC -COs 进一步证实了使用 hPSC- ALOs 和 hPSC-AWOs 鉴定出来的 SARS-CoV-2 抑制剂。一项研究还发现针对干扰素诱导的跨膜蛋白(interferon-induced transmembrane proteins, IFITMs)的肽或抗体,是 SARS-CoV-2 有效感染的辅助因子,可以抑制 SARS-CoV-2 在 hPSC-SIOs 中的进入和复制。
肾脏类器官
肾脏损伤,如急性肾脏损伤在 COVID-19 患者中很常见。因此,hPSC 衍生的肾脏类器官(kidney organoids, KOs)也被应用于研究 SARS-CoV-2 在肾脏中的感染。最近一项比较 2D 和 3D 肾脏近端小管上皮细胞中 ACE2 表达水平的研究发现,与 2D 培养条件相比,3D KOs 中 ACE2 的表达水平高出两倍,突出了将 3D 类器官应用于 COVID-19 疾病建模的重要性。对 3D 悬浮培养中 hPSC 衍生的 KOs 进行 scRNA-seq,进一步发现ACE2在部分近端小管细胞和荚膜细胞中的表达。因此,hPSC-KO 被证明允许 SARS-CoV-2 感染并支持病毒复制。研究还发现,人类可溶性 ACE2 变体和临床级人重组可溶性 ACE2(hrsACE2)都可以中和 hPSC-KOs 中的SARS-CoV-2 的感染性。最后,一种人类二氢乳酸脱氢酶抑制剂 MEDS433 也被发现可以抑制 SARS-CoV-2 在 hPSC-KO 中的感染,突出了类器官在药物发现应用中的重要作用。
肝脏类器官
据报道,COVID-19 患者肝功能异常和肝损伤的发生率很高。肝脏相关并发症包括总胆红素升高和丙氨酸转氨酶异常等。由于肝细胞和胆管细胞是肝脏中两种主要的功能细胞类型,因此含有这些细胞类型的肝细胞和胆管细胞类器官均被用于 SARS-CoV-2 研究。在 hPSC 衍生的肝脏类器官(liver organoids, LOs)中,在大多数白蛋白阳性肝细胞中检测到 ACE2 表达。对 SARS-CoV-2 感染的人类 LOs 的转录谱分析揭示了几种上调的途径,包括细胞因子-细胞因子受体相互作用、白细胞介素(IL)-17 信号传导、趋化因子信号传导、肿瘤坏死因子(TNF)信号传导和 NF-κB 信号传导途径,而细胞代谢在很大程度上被下调,这与 COVID-19 肺部尸检样本中的转录变化相似。在肝管类器官模型中,一部分胆管细胞表达 ACE2,这已被证明是 SARS-CoV-2 的靶标。此外,从非酒精性脂肪性肝炎患者产生的肝管类器官对 SARS-CoV-2 假性进入病毒感染的允许性显著增加,表明非酒精性脂肪性肝炎可能是 SARS-CoV-2 感染的风险因素。另外,成体 LOs 也已被用于药物测试,使用瑞德西韦和 rsACE2 的联合治疗方法协同改善了原代人肝球状体中对 SARS-CoV-2 的治疗效果。
大脑类器官
COVID-19 患者往往还会出现一系列神经系统症状,包括嗅觉和味觉丧失,记忆力减退,甚至是危及生命的中风。hPSC衍生的大脑类器官(Brain organoids, BOs)包括全脑和区域脑特异性 BO,已应用于 SARS-CoV-2 研究。在 hPSC-BO 中,通过免疫染色在皮质、海马、下丘脑和中脑类器官中鉴定出 SARS-CoV-2 感染,但在神经元和星形胶质细胞中检测有限。发现星形胶质细胞可促进 BOs 中的 SARS-CoV-2 感染。一项针对 SARS-CoV-2 感染的大脑类器官的研究发现,先天免疫和神经变性基因被诱导。在受感染的神经元细胞中也检测到 Tau 蛋白从轴突到体细胞的分布和超磷酸化。BOs 中的 SARS-CoV-2 感染可以通过 ACE2 阻断抗体或通过注射 COVID-19 疾病患者的脑脊液来抑制。此外,DICER(一种切割双链 RNA 的蛋白质)的一种同构体 DICER1,可保护 BOs 免受 SARS-CoV-2 感染。
扁桃体类器官
目前针对类器官的许多工作都集中在宿主反应和药物发现方面。最近,开发了人类扁桃体类器官(tonsil organoids, TOs)来评估对 SARS-CoV-2 疫苗的体液免疫反应。通过对分离的原生人类扁桃体进行重新聚集而得到的 TOs,保持了扁桃体的细胞成分,并支持抗原特异性的体细胞超突变、亲和力成熟和人类 B 细胞的类别转换。来自不同供体的 TOs 被应用于评估基于腺病毒的 SARS-CoV-2 疫苗。在刺激后的第 14 天,来自几个供体的 TOs 的 CD8+ T 细胞激活和特异性 IgG 和 IgA 抗体都明显增加。突出了使用这些 TOs 来确定对候选疫苗的个性化反应的潜力。
与动物模型相比,类器官来源于人类的干细胞或成人组织,可以高度模仿体内器官的特征,分析类器官的形成可以加深对人类发育和组织/器官再生机制的理解。使用类器官平台进行的研究对 COVID-19 疾病建模和药物发现做出了重大贡献。然而,由于缺乏血管系统、免疫细胞和器官间通讯,类器官平台仍然存在一些局限性。下期文章会介绍类器官芯片面临的挑战和未来,敬请持续关注。
原文链接:https://www.nature.com/articles/s41592-022-01453-y
作为全球优质的临床前药物开发服务供应商,安必奇生物拥有丰富的体外模型构建、器官芯片开发等代理经验。提供优质、完善的器官芯片设计及开发服务,以帮助客户获取高仿、节能的生理学研究及药物开发工具。目前已建立能够模拟心脏、肝脏、肺、肾、脑、肠等器官的微结构和功能的芯片模型。可从材料、制备技术、仪器、以及商业化等方面实现个性化定制。欢迎免费咨询!
24小时服务在线

