从广义上讲,核糖核酸(RNA)疗法包括反义寡核苷酸(antisense oligonucleotides, ASO)、小干扰RNA(small interfering RNAs, siRNA)、微小 RNA(microRNAs, miRNA)、信使 RNA(messenger RNAs, mRNA)和单向导 RNA(single-guide RNAs, sgRNA)介导的 CRISPR-Cas9 系统,基本上可以通过不同的作用模式操纵任何感兴趣的基因。然而,RNA 疗法对核酸酶敏感,并且由于它们的大尺寸和负电荷而无法渗透细胞。通过临床可翻译的脂质纳米粒子(lipid nanoparticles, LNP)将 RNA 递送至靶细胞,为解决包括 COVID-19 在内的一系列危及生命的疾病提供了巨大的机会。
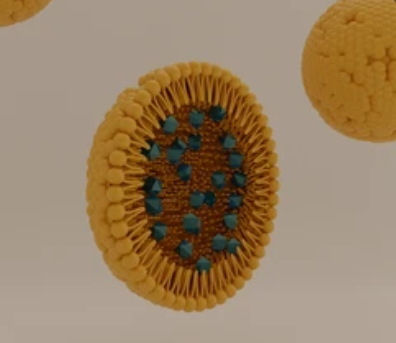
LNPs 通常由四种成分组成——可电离脂质、磷脂、胆固醇和聚乙二醇化脂质,其中,可电离脂质在保护 RNA 和促进其胞质转运方面起着重要作用。可电离脂质在酸性 pH 下带正电荷以使 RNA 凝结成 LNPs,但在生理 pH 下呈中性以将毒性降至最低。它们在细胞摄取后可在酸性内体中被质子化,并与阴离子内体磷脂相互作用形成与双层不相容的锥形离子对。这些阳离子 - 阴离子脂质对驱动双层结构转变成倒六边 HII 相,这有助于膜融合/破坏、内体逃逸和货物释放到细胞质中(图 1)。
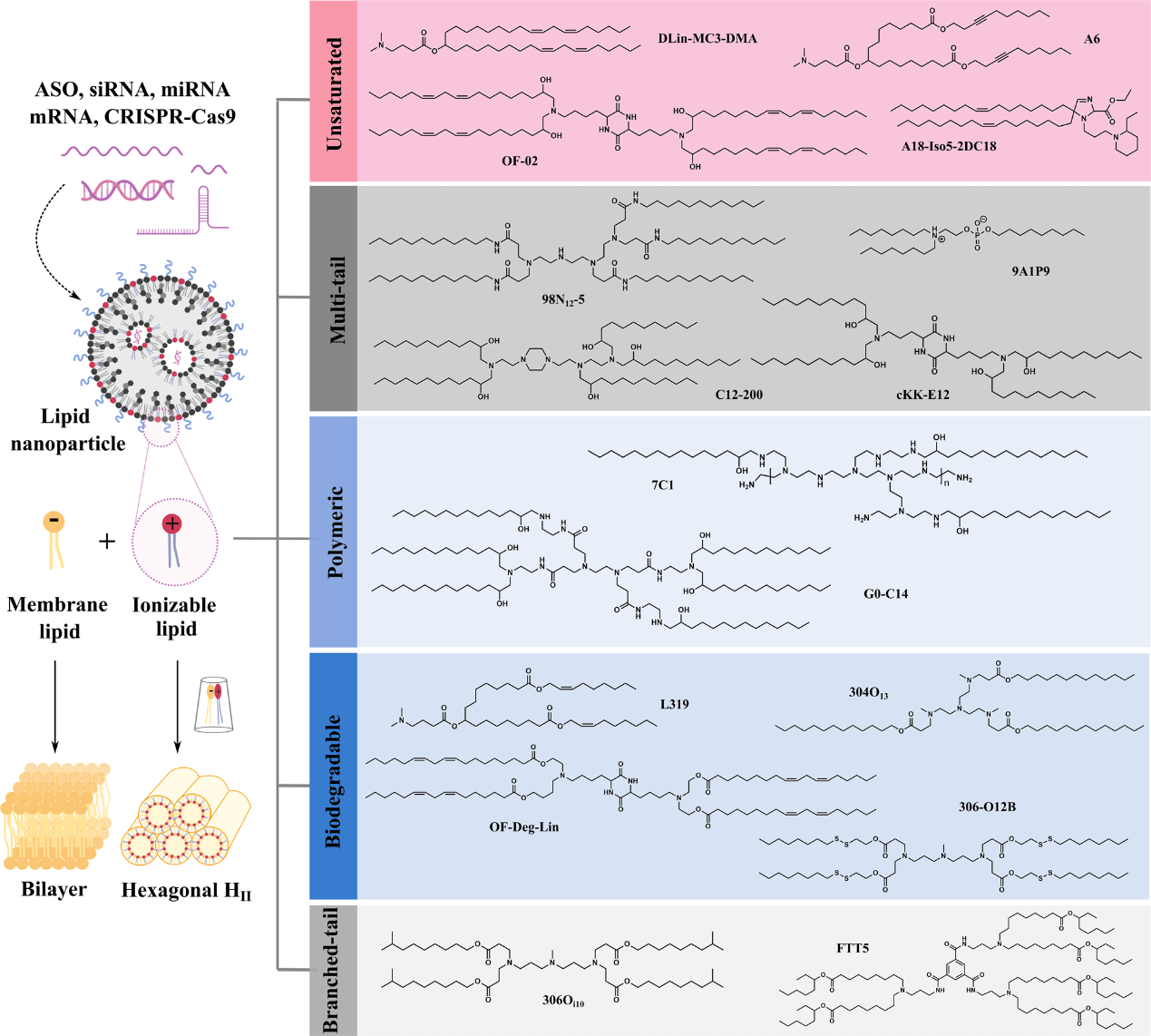 图1. 可电离脂类破坏内体的机制和五种主要的可电离脂类结构。
图1. 可电离脂类破坏内体的机制和五种主要的可电离脂类结构。
自 2008 年以来,具有不同化学特性的可电离脂质已被创造出来。基于它们的结构对这些脂质进行系统分类可以极大地有益于该领域并促进下一代可电离脂质的开发。目前,有五种主要的可电离脂质类型广泛用于 RNA 递送(图 1)。接下来对这五种可电离脂质类型进行简单介绍。
尾部饱和度极大地影响可电离脂质的流动性和递送效率。将尾部不饱和度从 0 增加到 2 个顺式双键,与双层脂质形成非双层相的趋势增加相关,从而导致膜破坏和有效载荷释放增强。因此,在可电离脂质 DLin-MC3-DMA(MC3)的优化过程中,选择亚油酸尾部作为结构基础。这种可电离的脂质赋予了强大的肝脏基因沉默功能,并被用于FDA批准的第一个用于治疗遗传性转甲状腺素淀粉样变症(hereditary transthyretin amyloidosis, hATTR)的 siRNA 药物 Onpattro®。重要的是,MC3 的结构和配方都为 LNP 的进一步发展奠定了基础。
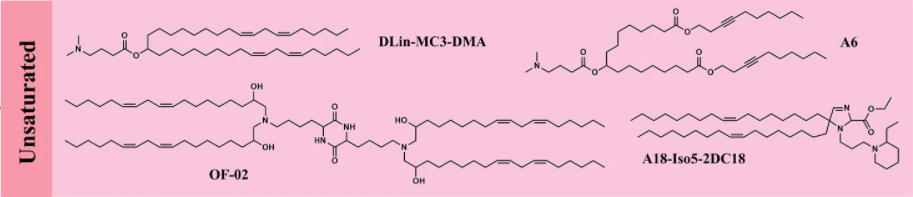
不饱和的可电离脂质已被证明可以增强 mRNA 的传递。有研究表明,亚油酸衍生的可电离脂质(OF-02)在同类产品中达到了最高的肝脏 mRNA 递送和蛋白质表达。接着,又证明一种炔烃可电离脂质(A6)在纳入基准 LNPs(如 MC3)时可以极大地增加膜融合并促进白蛋白介导的 mRNA 递送。有趣的是,在一个由三组分反应制备的杂环类可电离脂质库中,研究人员发现了一种亚烷基酮衍生的 A18-Iso5-2DC18,不仅可以稳健地递送 mRNA 疫苗,还可以激活干扰素基因刺激物(STING)途径。然而,可电离脂质中包含的不饱和键并不总是与体内 RNA 的有效递送相对应,表明合理设计和筛选都是必要的。
多尾可电离脂质因具有三个或更多尾而在结构上与双尾脂质有所不同。由于尾部区域的横截面增加,预计这种可电离脂质会产生更多的锥形结构,增强内体破坏能力。多尾可电离脂质可以通过组合化学轻松合成,并进行高通量筛选。自 2008 年创建第一个组合库以来,已经发现了数个多尾可电离脂质可以有效地敲除肝脏基因。
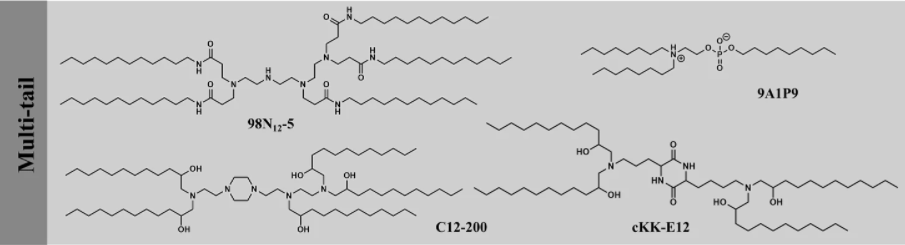
虽然最初是为 siRNA 递送而开发的,但多尾可电离脂质也可以通过实验方法的设计优化 LNP 组成来用于高效的 mRNA 递送,并显著减少了工作量。例如,与标准配方相比,C12-200 的优化配方使 mRNA 表达增加了 7 倍。最近,一类多尾可电离的磷脂被创造出来,其中表现最佳的 9A1P9,包括一个两性离子头部和三个尾部,有助于促进膜不稳定和货物释放,大大增强了 LNP 介导的组织选择性 mRNA 递送和基因编辑。然而,多尾可电离脂质通常具有稳定的骨架和低降解性,因此应始终考虑其毒性和免疫原性。
用烷基尾部取代阳离子聚合物上的游离胺得到可电离的聚合物-脂质,其可以通过疏水聚集增强粒子形成。研究人员从 500 种不同结构的合成聚合物-脂质杂化物中鉴定出 C15 环氧化物修饰的低分子量聚乙烯亚胺(7C1)可提供最有效的非肝脏 siRNA 递送。7C1 优先转染多个器官中的内皮细胞——而不是肝细胞和肺上皮细胞,其中肺部的内皮基因沉默率最高。在非人类灵长类动物中,7C1 在肺部实现了约 80% 的内皮基因敲低,而没有显著的毒性,表明其具有治疗内皮功能紊乱相关疾病的潜力。最近,重新优化的配方被进一步证明可以在骨髓内皮细胞中实现有效的基因沉默,可以进一步调节造血细胞活性。
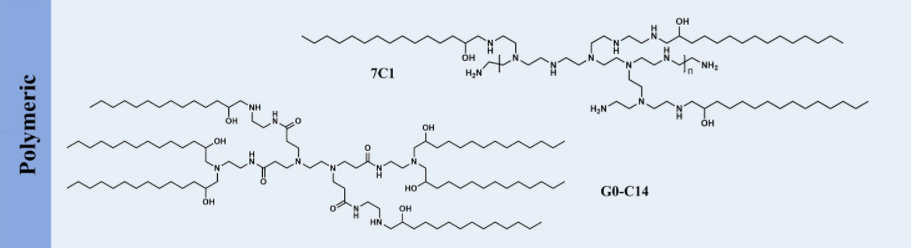
另外,由聚(酰胺)和聚(丙烯亚胺)聚合物衍生的可电离聚合物脂质也显示出转染肝脏内皮和肺部血管的高活力,意味着内皮细胞对基于聚阳离子的可电离脂质的优先转染。然而,可电离聚合物脂质,甚至在纯化后,通常会包括不同取代化合物的混合物,增加了其复杂性。此外,有毒的聚阳离子核心和不可降解的骨架为临床转化带来了额外的障碍。
为了减少积累和潜在的副作用,可电离脂质在细胞内货物成功递送后应该很容易降解为无毒的代谢物,这对于需要重复给药的 RNA 治疗尤其重要。将生物降解性引入可电离脂质的常见策略,是加入在生理 pH 下稳定但在组织和细胞内酶促水解的酯键。例如,由于 MC3 中的二亚油基尾部降解缓慢,通过用伯酯取代每个尾部中的一个双键,创建了可生物降解的替代物(L319)。L319 不仅保持体内效力,而且显示出快速消除和改善的耐受性。值得注意的是,酯基团的位置和空间效应可以极大地影响可电离脂质清除率和效力。
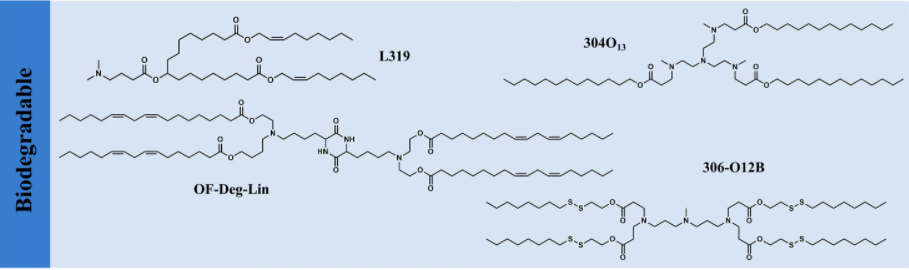
除了合理的设计,可利用烷基胺和丙烯酸酯尾部组合合成结构多样的可生物降解的脂质。值得注意的是,与不可降解的类似物相比,含酯的可电离脂质通常表现出较低的效力,这是由于快速水解造成的低效率递送。这表明需要平衡活性和可降解性之间的关系,以实现总效益的最大化。
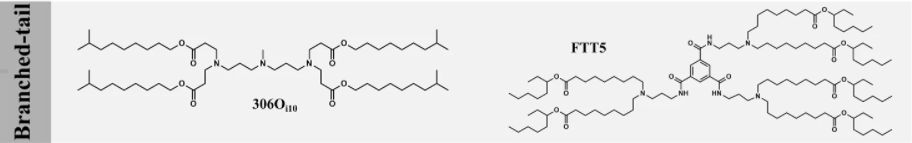
除了尾长和饱和度,尾部分枝也会极大地影响可电离脂质的性能。含有甲基丙烯酸酯尾部(靠近头部的 1C 分支)的可电离脂质与基于丙烯酸酯的脂质相比,通常显示出较低的功效。有趣的是,含有丙烯酸异癸酯(Oi10,末端有一个 1C 分支)的可电离脂质与它们具有线性尾巴的异构体相比,能极大地提高肝脏 mRNA 的表达(>10倍),这种效力的增加可以解释为由于间隔的可电离脂质在内体 pH 下有更强的质子化作用,并且脂质尾部的横截面增加,允许更多的锥形的结构,从而增强了内体逃逸。研究证实,可电离脂质(306Oi10)可有效地将多种 RNA 构建体共同递送至肝脏,并转染 > 80% 的肝细胞、枯否细胞和内皮细胞,展示了整合不同治疗方式(例如基因沉默、表达和编辑)来治疗肝功能障碍的潜力。
在 Onpattro® 于 2018 年获批之前的数十年间,科学家们已经筛选了众多可电离脂质和 LNP 制剂。MC3 的成功重新点燃了对 RNA 递送研究的热情,并大大加速了其他基于 LNP 的 RNA 疗法的临床开发,尤其是 mRNA 疫苗(图 2)。具体而言,在 COVID-19 大流行不到一年的时间里,两种基于 LNP 的 mRNA 疫苗(mRNA-1273 和 BNT162b2)经历了前所未有的发展速度,并在显示出 94% 以上的保护效力后获得了历史性的紧急使用批准。目前,由 LNP 递送的其他 COVID-19 mRNA 疫苗正在进行临床开发。虽然这些可电离脂质的结构尚未公开披露,但根据现有专利和文献显示了可能的结构(图 2)。
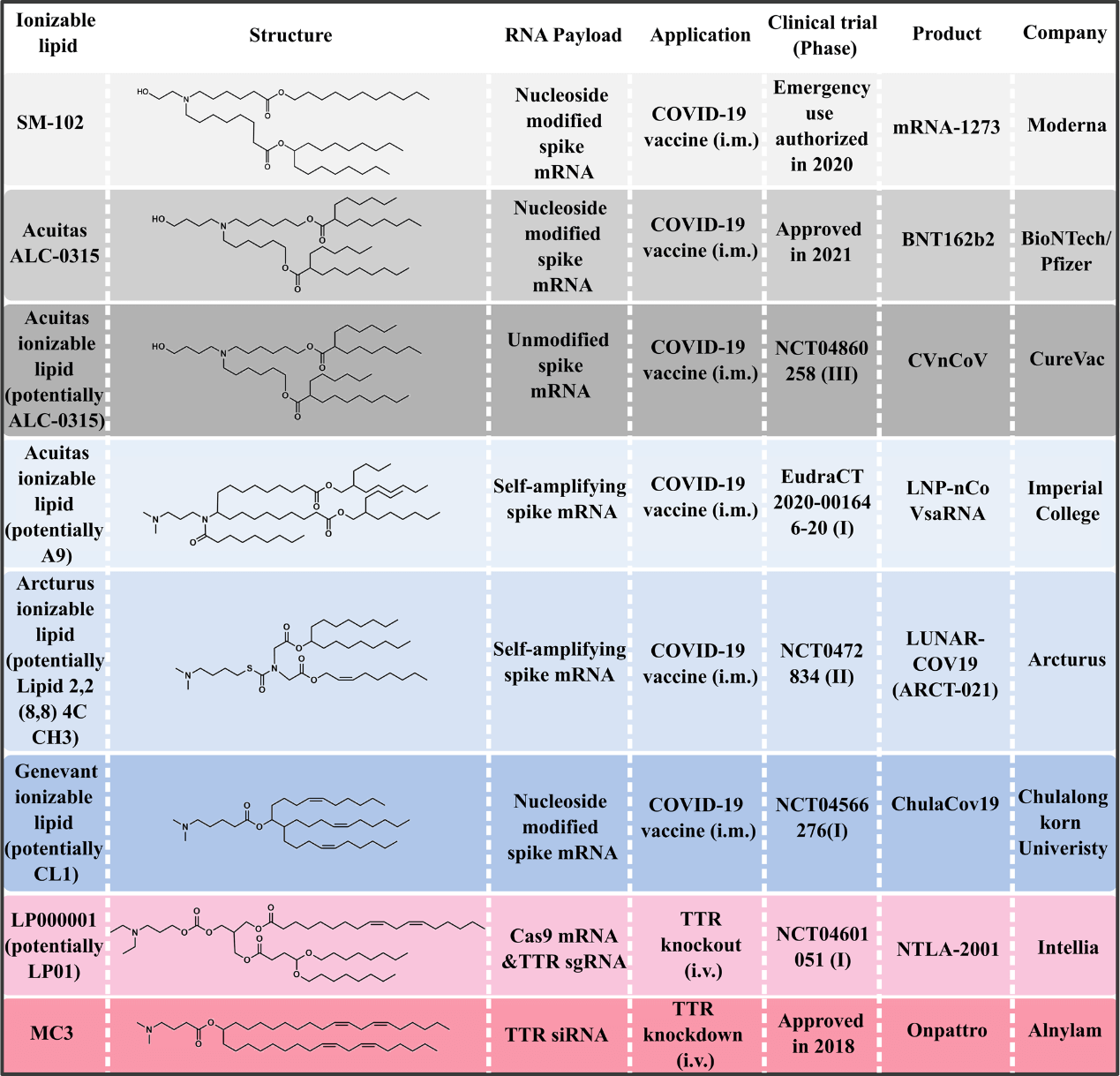 图 2. 用于 COVID-19 mRNA 疫苗和其他 RNA 疗法的临床开发中选定的可电离脂质。
图 2. 用于 COVID-19 mRNA 疫苗和其他 RNA 疗法的临床开发中选定的可电离脂质。
最近,首个由 LNP 支持的 CRISPR-Cas9 体内基因编辑人体试验的阳性结果被披露。单剂量的 LP000001 配制的 LNPs 携带靶向甲状腺素运载蛋白(transthyretin, TTR)和 Cas9 mRNA 的 sgRNA,导致 hATTR 患者的血清 TTR 降低 87%,并且仅观察到很少或轻微的不良事件。该研究预示着 LNP 介导的体内基因编辑时代的到来。
可电离脂质是引起急性免疫反应和长期毒性的关键 LNP 成分。虽然可降解的可电离脂质可用于缓解这一问题,但仍需要在 LNP 输注前预先使用糖皮质激素和抗组胺药。为了克服这个问题,优化连接剂的化学成分和加入抗炎特性仍需进一步研究。
由于合成过程繁琐,合理设计的可电离脂质候选物的制备具有挑战性。例如,合成 MC3 需要四个合成步骤和一个星期的密集操作,准备所有类似物也是一个巨大的负担。目前,临床可电离脂质都是通过多个步骤合成的,这导致了可扩展的制造挑战。通过采用组合化学来简化合成和加速可电离脂质筛选,可以缓解这个问题。然而,使用这种方法合成的性能最好的可电离脂质通常包含稳定的骨架和多个叔胺,导致降解缓慢和潜在的毒性。因此,迫切需要开发新的组合反应,以产生可降解的可电离脂质,用于有效的 RNA 递送。同时,在这些脂质中引入额外的功能模式(如 STING 激活)对于特定的 RNA 疗法和疫苗应用具有重要价值。
可电离脂质介导的肝外递送是 RNA 疗法广泛应用的另一个挑战。全身给药后,中性 LNPs 主要定位于肝脏,而与可电离脂质无关。虽然据报道大多数基于酯的可电离脂质主要转染肝脏,但 OF-Deg-Lin 却表现出主要的脾转染。进一步揭示结构和器官选择性之间的关系将极大地有利于肝外 RNA 递送。除了被动靶向肝外组织外,合理设计的具有靶向能力的可电离脂质有望改善非肝脏递送。例如,一种神经递质衍生的可电离脂质已被证明可以保留其主动运输穿过血脑屏障(BBB)的能力,使得以前不渗透 BBB 的 LNPs 成功地将 ASOs 递送至大脑中。
近年来,关于 RNA 疗法的研究有了令人难以置信的增长,这大大受益于这几十年来对脂质纳米颗粒的研究,特别是其关键成分--可电离脂质。本文介绍了主要的可离子化脂质类型,并讨论了未来发展的方向。基于目前的研究进展和临床状况,可降解骨架和增加的分支/尾部是未来可电离脂质发展的两个最有利的结构特性。除了安全性和效力外,具有靶向和免疫调节等附加功能的下一代可电离脂质对于特定应用也十分重要。因此,可电离脂质的优化和创新仍有广阔的机会,以实现 RNA 疗法和疫苗的更广泛转化。
原文链接:https://www.nature.com/articles/s41467-021-27493-0
安必奇生物致力于为国内外客户提供 MicroRNA Agomir/Antagomir 递送系统研究和分析相关服务。代理技术团队拥有多年的运载体定制经验,能在较短的时间内为客户提供理想的载体筛选和制备服务。另外,还完善了一整套 miRNA 的合成及纯化技术,能够提供优质的 miRNA 合成产品,促进客户相关项目的快速进展。欢迎免费咨询!
24小时服务在线

