多个器官之间的相互作用对于确保人体正常的生理功能至关重要。虽然各器官在体内是独立存在的,但它们会通过血液和淋巴循环由各种信号因子(如可溶性因子、外泌体、细胞等)介导相互交流,以维持整体活力和体内稳态。例如,口服药物在体内的旅程需要通过不同的器官,其中每个器官都有特定的功能:小肠吸收物质,肝脏将其代谢,然后通过血液循环输送到目标器官,肾脏排出相应的废物。吸收/分布/代谢/排泄/毒性(ADMET)的每个过程都会影响药物暴露于组织的药效水平和动力学,从而影响化合物作为药物的性能和药理活性。
此外,身体的许多功能和过程还涉及内分泌系统多器官的调节和激素反馈,例如不孕症和神经退行性疾病等许多疾病涉及多种器官,因此必须采用系统方法对它们进行准确建模。研究模型的系统性和跨器官交流是破译和模拟生理功能的关键。以前,跨器官交流和系统维度要素通常是通过使用动物模型来实现的,常常受到实验成本较高、吞吐量有限、伦理问题等因素的限制,而遗传背景差异也是导致临床试验经常失败的主要原因。因此,亟需开发结合系统维度和多器官的先进体外模型,更加真实地模拟人类健康和病理生理,用以了解多器官疾病和开发个性化治疗新途径。
以前的研究采用条件培养基或 Transwell 平台的培养物在体外研究器官通讯。然而,Transwell 装置使用了大量液体,低浓度的信号因子会被稀释,阻碍了细胞通讯的研究。此外,培养物完全是静态的,缺乏对动态过程的模拟和对受控细胞生化和/或物理刺激的应用。研究发现,使用微流控设备可以通过提供亚毫升培养液体积、动态培养以及对细胞/组织附近的物理和化学参数进行精确的时空控制。例如,通过使用由多孔膜、柱状阵列或通道分隔的腔室,可以在连续流动的微装置中研究细胞之间的交流。在这些微流控细胞培养物的基础上,结合 3D 生物工程结构,器官芯片(organ-on-a-chip, OoC)设备应运而生,可在体外精准模拟器官的结构和功能。OoC 领域已经发展了十数年,几乎所有的人体器官和生理屏障都被提出了相关模型。Nature 杂志曾发表评论,称 OoC 是未来可能替代动物试验的革命性技术[1]。
大多数 OoC 模型都是基于单一的细胞类型或组织,缺乏系统的维度和跨器官交流。在最近的研究突破中,多种器官被建模在单一的设备中,成为一个多器官芯片(Multiorgan-on-a-chip, multi-OoC)平台(下图)。Multi-OoC 可在不同功能区域同时构建多个组织器官,并通过芯片管道(模拟人体血管)相连接,模拟人体对特定物质的吸收、代谢、转化和排泄等过程。
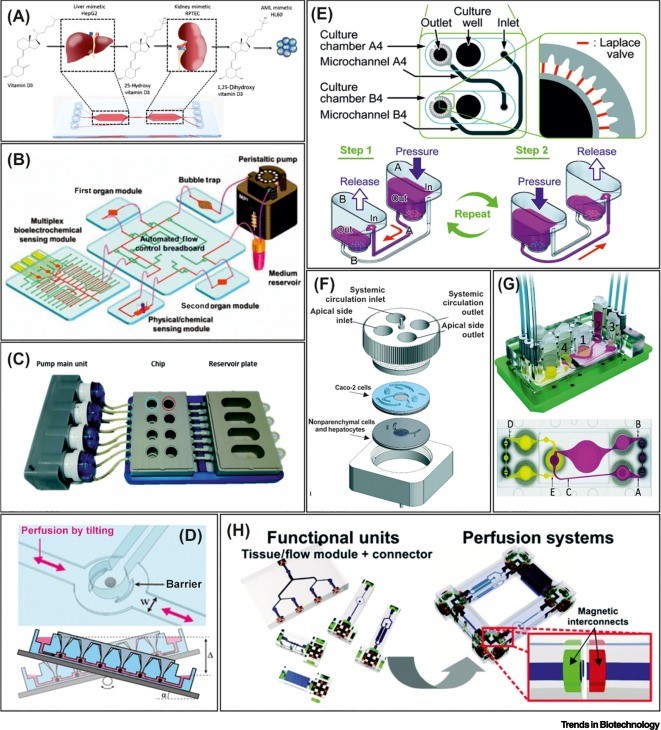 多器官芯片设备。
多器官芯片设备。
Multi-OoC 可以根据设备结构分为两种类型,即通过连接单个 OoC 单元或直接使用 multi-OoC 板。第一种 multi-OoC 类型中,单个 OoC 单元通过毛细管或微流体主板连接,以重现多个器官模型之间的系统相互作用(下图A)。这种模块化方法允许重新配置 multi-OoC 平台,并通过使用器官特异性微血管内皮细胞支持单个血管化器官的使用。单个的 OoC 模块在相互连接之前,可以先使用特定的培养基建立和成熟。第二种 multi-OoC 类型中,不同器官模型以单一板的形式集成在一起,板上的通道作为一个类似血管的系统来支持器官间的通讯(下图B)。当人体几乎所有的器官都被建模在一起,即称为“人体芯片”(下图C)。
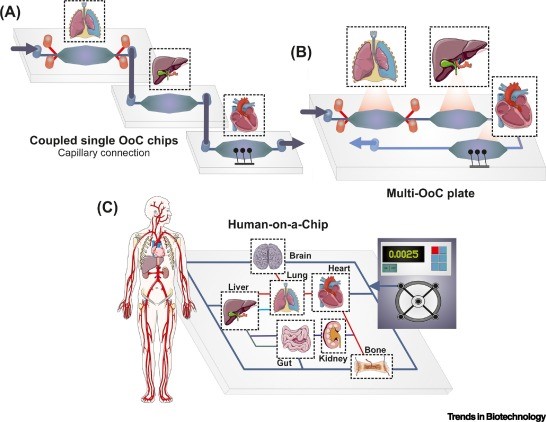 开发多 multi-OoC 系统的两种主要方法示意图。
开发多 multi-OoC 系统的两种主要方法示意图。
Multi-OoC 技术平台的创新思想建立在充分了解人体的复杂组织器官联系和生理功能特点的基础上,为疾病研究、药物研发以及毒性筛查等多领域提供了优良的体外研究模型,具有广泛应用价值。
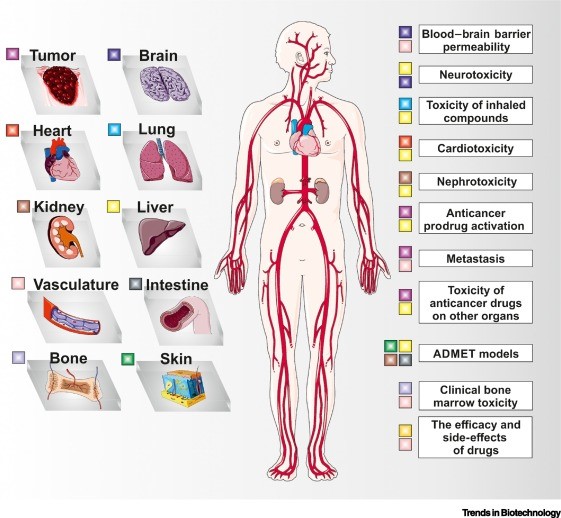 多器官芯片组合作为人体生理、病理模型在不同生物医学中的应用。
多器官芯片组合作为人体生理、病理模型在不同生物医学中的应用。
一般来说,毒性与肝脏代谢密切相关,因此为毒性目的而开发的 multi-OoC 平台应当包括肝脏模型和至少一个其他靶器官。例如,将人肝球状体与 3D 肺上皮模型相结合,用于慢性阻塞性肺病、哮喘或肺癌的发展有关的气溶胶的毒理学评估(下图)。对于药理学研究,通常将肠道模型添加到肝脏-靶器官共培养 multi-OoC 中以模拟药物吸收。当评估治疗的不良副作用时,亦可加入靶器官和其他预期会出现副作用的器官,例如肾脏(肾毒性)、心脏(心脏毒性)或大脑(神经毒性)。Multi-OoC 在毒性评估方面具有实用价值,可以减少实验动物的使用,提高临床前研究中药物评估的效率。
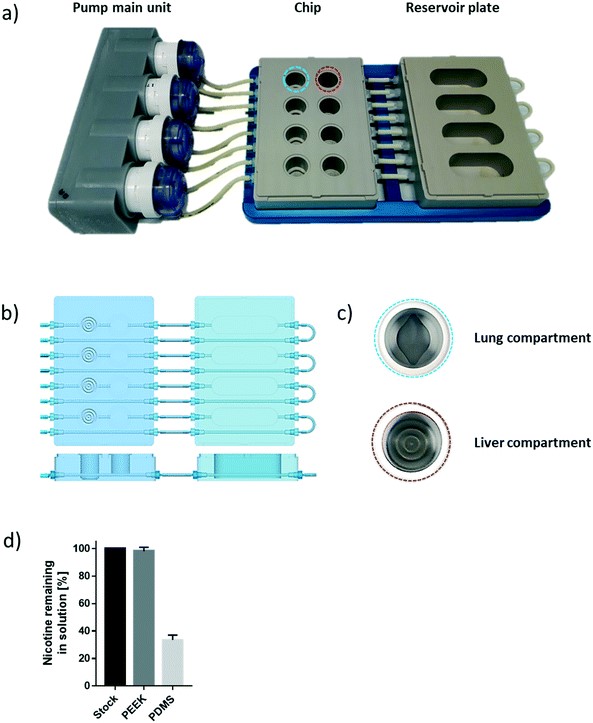 用于急性和慢性毒性研究的肺/肝芯片平台[2]。
用于急性和慢性毒性研究的肺/肝芯片平台[2]。
支持肝脏-靶器官交流的 multi-OoC 多器官平台为测试只有在肝脏代谢后才具有生物活性的前体药物提供了新的可能性。例如,使用肝脏-免疫系统共培养,通过模拟 3D 肝组织的药物代谢并评估由此产生的代谢物的免疫级联激活,成功地在体外预测了药物诱导的皮肤过敏(下图)。Multi-OoC 在研究药代动力学、不同器官细胞间通讯及代谢相互作用的假设检验等方面具有重要意义。
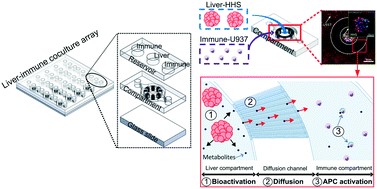 用于预测药物代谢引起皮肤过敏的肝脏/免疫系统共培养阵列[3]。
用于预测药物代谢引起皮肤过敏的肝脏/免疫系统共培养阵列[3]。
药代动力学(PK)研究旨在模拟药物在体内各组织器官中吸收、分布、代谢、排泄的动态变化过程,对于新药研发至关重要。例如,有研究表明尼古丁口香糖可作为一种口服药物用于神经退行性和炎症性肠病,研究人员将其添加到肠道芯片中,模拟口服给药的过程。当药物穿过肠壁,经过血管系统到达肝脏进行代谢,再到肾脏排出,结果发现,尼古丁口香糖到达每个组织的时间、每个组织中药物最高浓度,都与之前在病人身上所测量的水平非常接近(下图)。未来,进一步验证器官芯片系统与真实人体生理学的相符程度和开发用户友好的设备是 multi-OoC 走向商业化和更广泛应用的关键步骤。
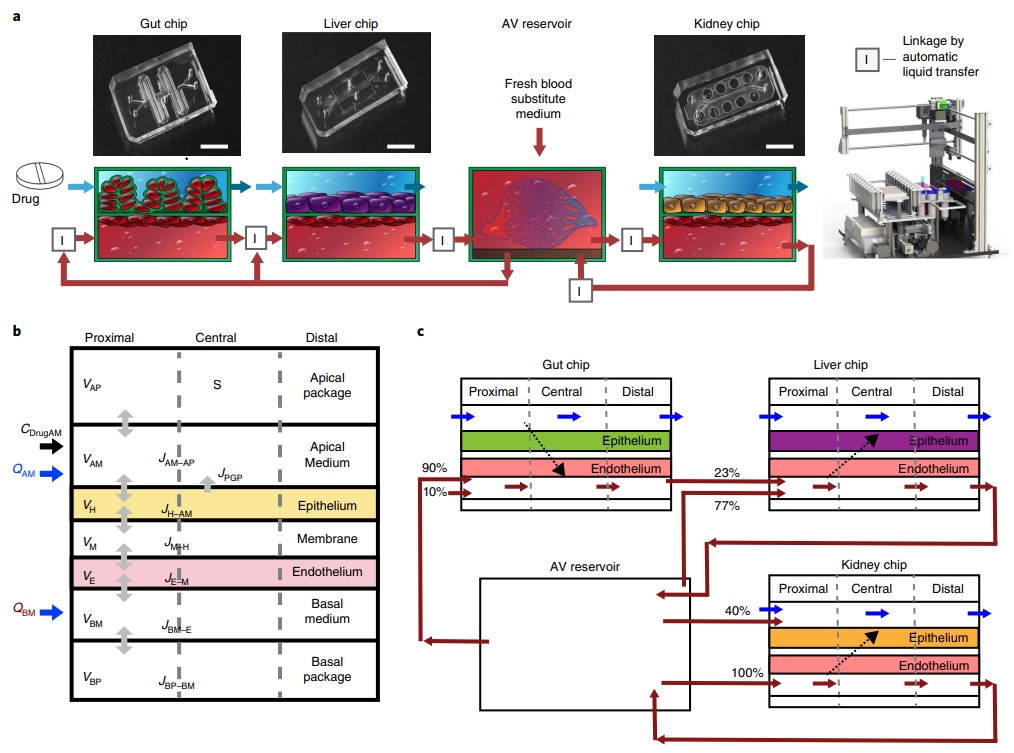 肠道/肝脏/肾脏多器官芯片平台[4]。
肠道/肝脏/肾脏多器官芯片平台[4]。
ADMET 研究通常需要特定的器官来模拟吸收(肠道)、分布(血液循环)、代谢(肝脏)、排泄(肾脏)和毒性(靶器官)的过程。研究人员将皮肤和肠道(模拟局部和口服给药)与肝脏和肾脏(再现药物代谢和清除)相结合,设计制造了四种器官共培养平台,所有四个器官的完整性和功能性都保持了长达 28 天(下图)。不断成熟的 multi-OoC 将通过降低临床试验失败率和制药行业的前期投入,在药物开发中发挥重要作用。
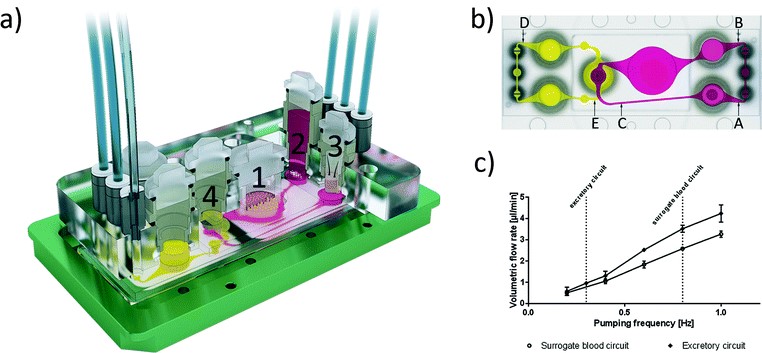 肠道/肝脏/皮肤/肾脏四器官芯片设备[5]。
肠道/肝脏/皮肤/肾脏四器官芯片设备[5]。
在疾病研究领域,multi-OoC 对于重现人类疾病特征、研究多因素参与的疾病病理机制提供了新的机遇。比如,利用肠芯片实现对多种组织细胞的共培养,包括上皮组织细胞、免疫细胞及致病菌等,从而可用来研究炎性肠病发病过程中细菌和淋巴细胞的相互作用特性[6]。此外,模拟大脑不同功能的多模块系统解析了不同细胞对整个器官功能的贡献,并揭示了神经元和血脑屏障(BBB)微血管细胞之间的代谢耦合[7]。此外,multi-OoC 也被用于癌症研究。例如,将 3D 结直肠癌和肝脏模型耦合在双器官芯片中,实时监测癌细胞迁移,揭示了肝脏中转移簇的形成,以及肝脏微环境的机械特性对癌症扩散的影响[8]。这些例子说明了复杂的体外 multi-OoC 模型在疾病研究领域的巨大应用潜力。
与此前的临床前药物检测工具相比,多器官芯片具有不可替代的优势。其低成本、低材料消耗、高通量筛选和较少伦理争议的特性非常符合当前制药行业的需求。此外,多器官芯片最宝贵的优势是能够为临床前试验提供更真实的数据,尤其是安全性方面的数据,可以最大程度保证临床试验的安全。本部分综合介绍了多器官芯片的发展与优势,概述了现阶段多器官芯片的应用领域。后续还会介绍多器官芯片面临的挑战和未来,欢迎阅读。
参考文献
作为全球优质的器官芯片模型开发服务供应商,安必奇生物拥有丰富的体外模型构建、器官芯片开发等代理经验。我们的器官芯片模型基于微流控技术,具有微环境可控、测量信息丰富、成本低、自动化和高通量等许多优点。其中,构建的心脏/肝脏/肿瘤 MOC 模型可以帮助客户以更高的准确度预测药物的功效和毒副作用,促进药物开发过程,提升新型治疗策略的开发潜力,欢迎免费咨询!
24小时服务在线

