心脏疾病对人类健康具有重大威胁,慢性心脏损伤和急性心脏损伤都可能逐步发展为心力衰竭,造成心脏收缩力丧失,导致对身体的血液输送不足。在北美,心力衰竭引起的并发症是最常见的住院原因,也是世界范围内死亡和残疾的主要原因之一。现有的药物治疗在减轻疾病症状或改善患者发病率或死亡率方面的功效不足,并且可能具有显著不良副作用。若要开发能够更好地纠正潜在器官或细胞功能障碍的新药物,需要一个能够概括人类心脏组织生理学和病理生理学的心脏模型,以及能够量化疾病条件下或药物测试期间其功能特性的动态变化的技术。

长期以来,动物体内模型一直是评估心脏疗法的黄金标准,因为器官可以作为一个整体来研究,并存在遗传操纵的好处。然而,动物模型中参与收缩性、钙处理、代谢和发育的蛋白质的表达与人类存在关键差异。在临床前药物评估中,以动物模型为基础的检测方法转化不佳情况普遍,约三分之一的新药在人类临床试验中因意外的心脏毒性而失败,造成了昂贵的开发失败成本,且有可能损害患者健康。此外,使用动物模型的检测通量很低,不允许同时评估大量的候选药物。而人类原代性心肌细胞获取困难、培养寿命有限且不增值阻碍了人类体外心脏模型的建立。
由于干细胞技术的突破,来自人类胚胎干细胞(hESC-CMs)或诱导多能干细胞(iPSC-CMs)的心肌细胞已成为重要的临床前研究替代物,该模型提供可靠的细胞来源,包含人类蛋白质组,避免了动物模型存在的物种差异问题。此外,使用具有特定基因型的病人来源的 iPSC-CMs 可以在体外重现人类疾病的表型,有利于疾病机制的研究和靶向疗法的开发。早期的体外心脏模型是通过在标准培养皿上培养心肌细胞建立的,在模仿体内组织微环境和评估心肌细胞功能特性方面存在局限性。如今,利用微细加工技术,新兴的心脏芯片平台已经被开发出来,可用于培养单个心肌细胞、二维细胞单层和三维心脏组织(图 1)。体外心脏模型可以在受控的微环境中建立,并集成生物传感元件,以分析复杂的细胞、组织功能特性。
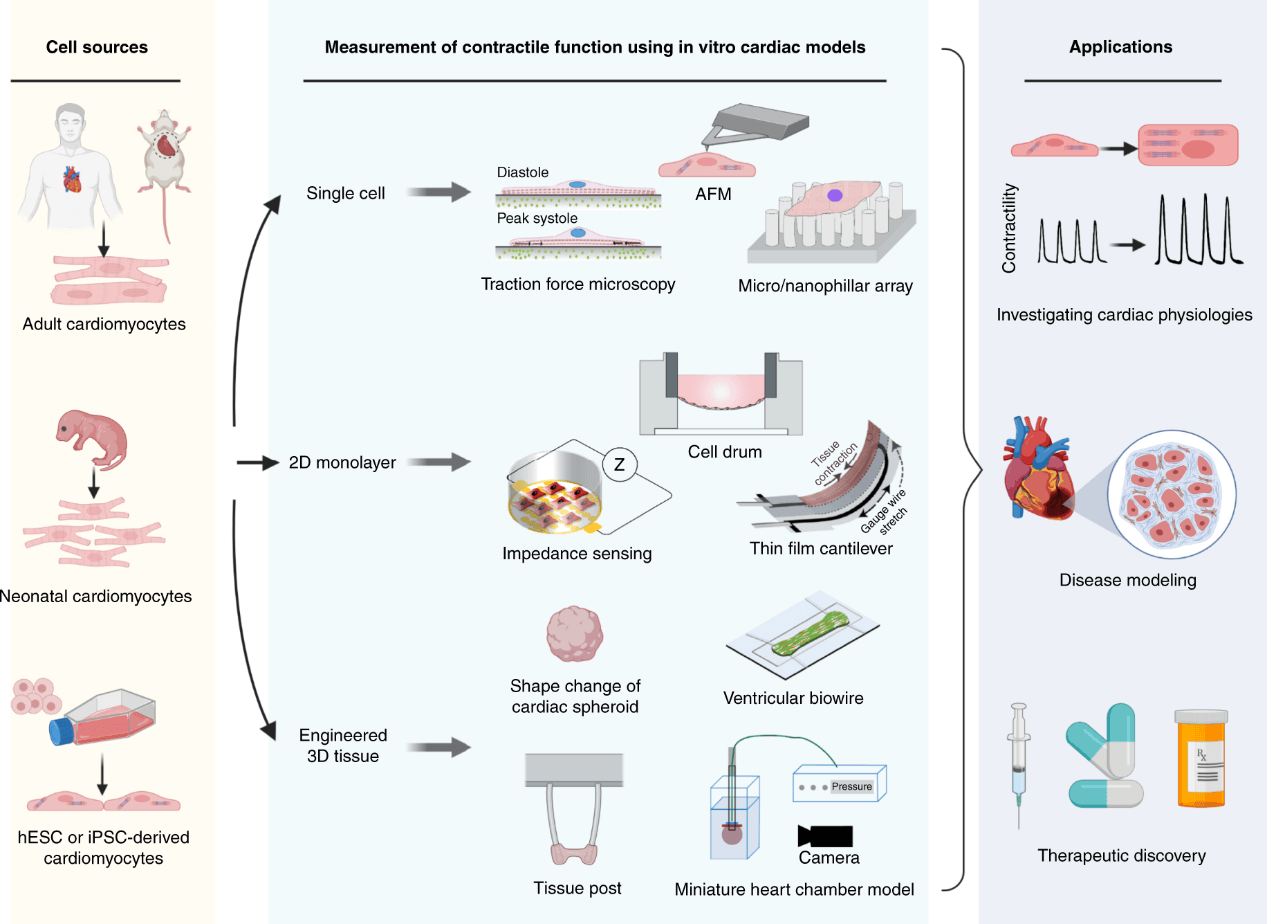 图1.体外心脏模型收缩功能的评估和应用的示意图。
图1.体外心脏模型收缩功能的评估和应用的示意图。
在心脏通过循环系统泵送富氧血液的过程中,足够的收缩力起着核心作用。在细胞水平上,心肌细胞的收缩遵循"兴奋-收缩耦合",其中从相邻细胞传播的电动作电位触发膜去极化。细胞内的 Ca2+ 浓度随后因通过 L 型钙通道的 Ca2+ 流入和细胞内钙从肌浆网释放而增加。钙离子与收缩蛋白(肌钙蛋白)结合,启动粗丝(肌球蛋白)和细丝(肌动蛋白)的相对运动,导致肌节的缩短。各个心肌细胞产生的收缩力是相加的,导致了人类心脏的同步跳动。心肌细胞收缩功能的不良表型,例如收缩力降低或跳动率、节律的变化,是心脏病和心力衰竭病理生物学的关键。心肌细胞或心脏组织的收缩力是评估心脏病理生理学和对药物干预反应的重要参数。因此,有必要在心脏芯片平台上集成生物传感组件,以评估体外心脏模型的收缩功能。
(一)两点力传感器
在用于测量单个心肌细胞收缩力的早期仪器中,力传感器被连接到细胞的两端。使用带皮细胞进行测量以研究形态变化(例如,肌节缩短)或使用完整的心肌细胞来研究兴奋-收缩耦合机制。其中,碳纤维技术是最常用的,因为纤维尖端可以自然地附着在细胞表面,不需要使用粘合剂。如图 2a 所示,两根碳纤维被插入玻璃吸管,安装在微机械上,并连接到心肌细胞的两侧。一根纤维是坚硬的,作为机械锚,而另一根纤维的顶端是顺应性的,可以记录力。除了宏观尺寸的传感器外,还可以利用微细加工技术建造一个只有几立方毫米大小的小型化两点力传感器。如图 2b 所示,心肌细胞的收缩引起了多晶硅应变片电阻的变化。该装置能够解析从 100 nN 到 50 µN 的力。
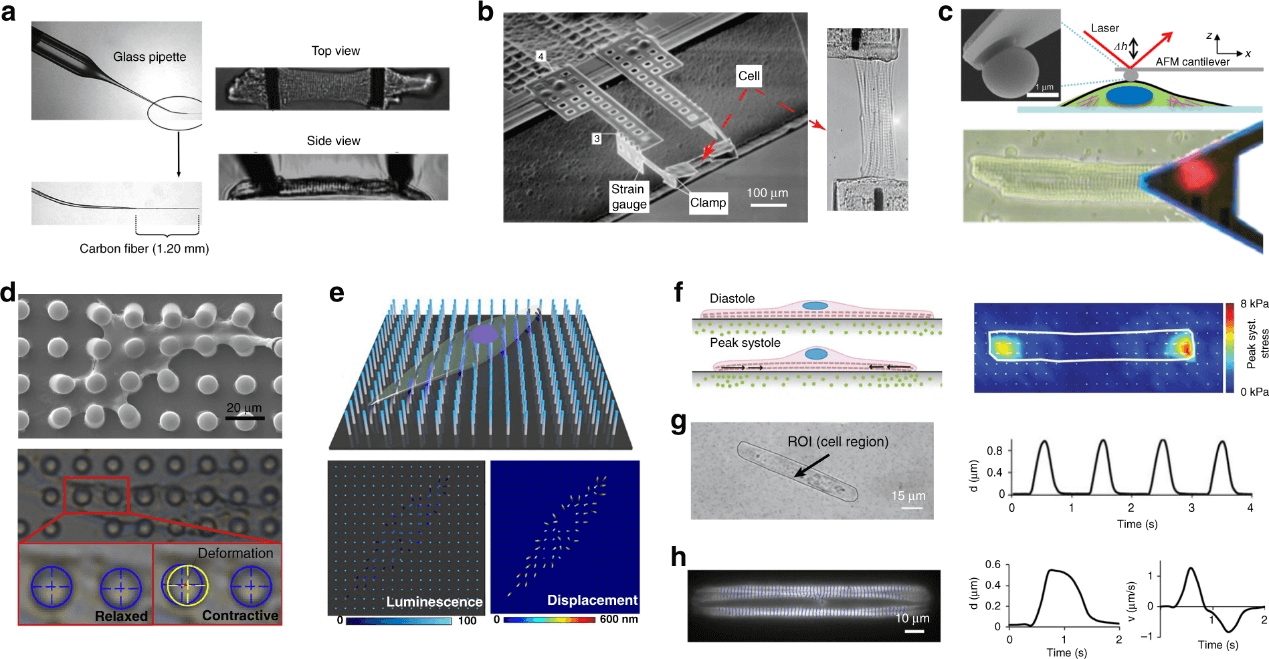 图2. 单个心肌细胞的收缩功能测量。
图2. 单个心肌细胞的收缩功能测量。
(二)原子力显微镜
原子力显微镜(AFM)通常也用于在微米和纳米级表征固体材料和生物样品的机械性能。图 2c 显示了用于收缩性测量的 AFM 悬臂的设置。用 AFM 悬臂轻轻接触细胞表面后,z-piezo 将锁定在其位置。细胞跳动引起悬臂的垂直波动,通过测量反射的激光束的位移来检测这些波动。垂直方向上的力根据偏转信号和悬臂的弹簧常数来量化。AFM 测量已被应用于评估病态心肌细胞的收缩缺陷,并在单细胞水平上评估药物的效果或细胞毒性。此外,AFM 还被用于绘制单个心肌细胞的局部弹性,并研究收缩和细胞内钙浓度变化之间的时间关系。
(三)微米/纳米柱阵列
微柱基质已经被用来测量由单细胞包括心肌细胞产生的牵引力,图 2d 显示了一个使用软光刻技术制作的直径为 2 - 10 µm 的柔性聚二甲基硅氧烷(PDMS)微柱阵列。在用细胞外基质(ECM)进行微接触印刷和细胞播种后,心肌细胞粘附在多个微柱的顶端并扩散。由心肌细胞收缩引起的微柱的偏转被记录下来,通过光束弯曲理论进行分析,可计算出单个跳动的心肌细胞的收缩力。最近有研究提出了一个排列整齐的 InGaN/GaN 纳米柱阵列,命名为压电光电子纳米天线阵列,通过纳米线尖端的光致发光强度或位移的动态变化,实现对整个单个心肌细胞的力分布的高分辨率(800 nm)绘图(图 2e)。
(四)牵引力显微镜
牵引力显微镜(TFM)是一种非侵入性的技术,用于测量在一个更接近原生硬度的微环境中的细胞水平牵引力。通常以 1-30 kPa 的硬度范围制作柔软的聚丙烯酰胺凝胶或 PDMS 基质,并以 ECM 蛋白进行表面功能化,用于细胞培养。荧光珠(直径 0.05 - 0.5 µm)被嵌入顶面或弹性基质内,作为基准标记。通过图像交叉相关技术(如粒子图像测速)跟踪荧光珠在最大收缩和放松阶段之间的平面位移来测量细胞跳动引起的基质变形(图 2f)。基于位移场和基质弹性模量,使用傅里叶变换牵引细胞仪可计算收缩幅度和分布。
(五)基于视频的细胞运动检测
还有一种评估细胞收缩性能的间接方法,是利用心肌细胞跳动期间心肌细胞形状或肌节尺寸变化的光学成像。在显微镜下记录心肌细胞收缩的时间序列后,可以利用图像处理技术来量化细胞的跳动行为,如透射光强度的周期性变化,边缘检测来量化细胞的形状变化,以及数字图像关联来计算收缩应变或位移大小(图 2g)。也可以从具有清晰的肌层条纹的明视野视频或标记的肌层的荧光视频中量化肌层缩短的分数,作为产生力的指标(图 2h)。这种方法的主要缺点是动力学参数和收缩力之间的关系不明确。根据细胞的机械运动来估计收缩力的变化可能会引起测量误差。
(一)基于电阻抗的收缩性传感
使用交错电极(IDEs)的电阻抗测量最初是为了量化细胞粘附、形态、增殖、迁移和汇合的变化。如图 3a 所示,在 IDEs 上施加低交流电势后,电极对之间会产生离子流。当细胞在电极表面附着和扩散时,离子电流会发生变化,可通过电阻抗光谱学来测量。测量的阻抗信号的等效电路模型是由电极阻抗、溶液阻抗和细胞-电极界面阻抗组成。心肌细胞在动态跳动过程中的形态变化会引起阻抗大小的变化。阻抗生物传感器能够对细胞信号进行无标签、定量和长期记录,包括跳动幅度、跳动频率和节律。它们也有可与其他传感器整合,对心脏功能特性进行多参数测量。需要注意的是,有几个因素会影响信号模式,如电极尺寸、扫描频率、细胞粘附和不同培养日的细胞汇合度的变化。此外,外部的交流电流可能会带来一些副作用,扰乱正常的细胞生理结构。
(二)柔性薄膜平台
二维单层的收缩也可以通过细胞跳动所引起的柔性薄膜的机械偏转来表征。例如,CellDrum 是一个灵活的圆膜装置,其中一个薄的硅膜基质被密封并悬挂在圆柱形培养室的底部(图 3b)。灵活而薄的膜允许细胞粘附和扩散,在体外形成心肌细胞单层。心肌细胞单层的节律性收缩将膜向上抬起。收缩力是通过使用压力传感器来记录腔内的压差,或者使用激光偏转传感器来记录膜的偏转来测量的。另外有研究进一步将碳纳米管(CNT)复合应变传感器集成到 PDMS 悬浮膜中(图 3c)。该柔性膜装置阵列被用来在培养箱环境中进行收缩性、跳动率和跳动节奏的连续测量。
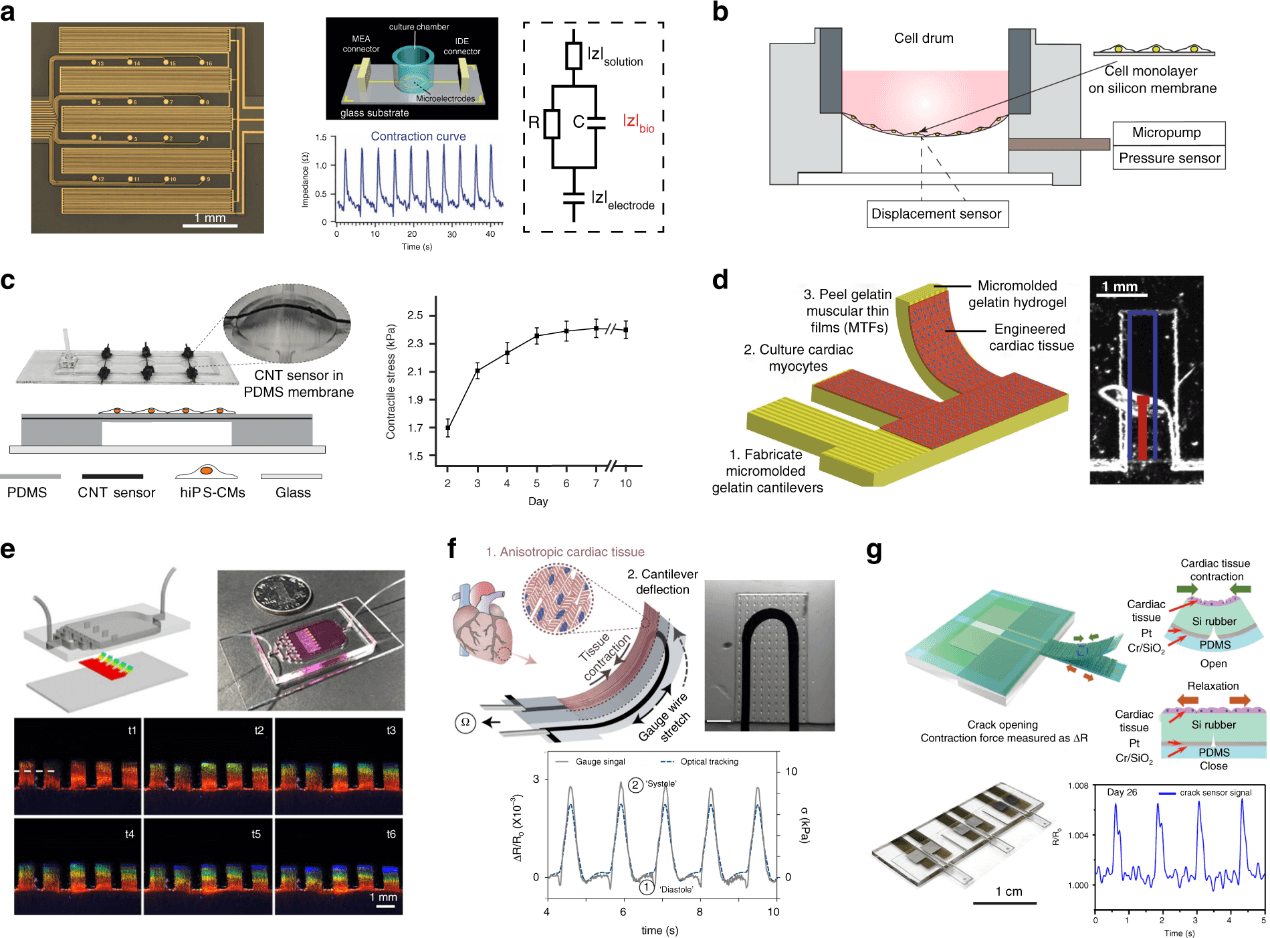 图3. 二维心肌细胞单层的收缩功能测量。
图3. 二维心肌细胞单层的收缩功能测量。
(一)3D 组织柱、悬臂和导线的收缩性测量
工程心脏组织(EHTs)是通过将细胞(心肌细胞、心脏成纤维细胞和内皮细胞)包裹在在与锚定结构连接的胶原/纤维蛋白水凝胶中来建立的。EHTs 已被广泛开发用于组织生理学分析、药物筛选、疾病建模和心脏修复。早期的 EHTs 被包裹在刚性的锚定结构上,如玻璃/金属棒、柱子、外科缝合线和钢针。对收缩的评估被省略了,通过插入外部探头进行(图 4a)或通过将组织转移到一个单独的测力平台上进行。使用外部力传感器无法连续测量组织的收缩功能。为了解决这个问题,目前开发了各种心脏芯片平台,以整合芯片上的力/应力感应组件,用于原位测量 EHT 收缩动态。其中有一种悬挂在两个软柱/悬臂之间的心脏组织模型,将心肌细胞与纤维蛋白和胶原蛋白水凝胶混合后,用移液器注入铸模,在铸模中放置一对柔性硅胶柱或 T 形垂直悬臂(图 4b)。经过 5 - 10 天的组织压实,心肌条被包裹到硅胶柱/悬臂上,表现出由被动机械张力引起的纵向排列。柱子/悬臂的机械性能、弯曲幅度和弯曲频率被用来计算 EHT 的收缩力和跳动率。
另一个有代表性的心脏芯片模型是柔性线平台。研究人员开发了一个 Biowire II 平台,由一个通过热压印在聚苯乙烯板上的微孔阵列和位于微孔两端的两根柔性聚合物线组成(图 4c)。圆柱形的小梁组织在每个微孔中形成,并悬浮在两根平行的聚合物线之间。与其他组织模型(50 - 200 万个细胞/组织)相比,小型化的微孔模型需要的心肌细胞更少(约 10 万个细胞/组织)。此外,生成的心房和心室 Biowires 具有特定改变的基因表达,表现出腔室特异性药物反应。目前已经建立了另一种具有代表性的心脏组织线模型,由丝状 3D 矩阵组成,以促进 3D 心脏组织的粘附和自组装,而无需 ECM 水凝胶。具有可调纤维刚度的合成平行纤维用于锚定 3D 心脏组织,通过改变纤维弯曲刚度提供不同的机械应力,并通过跟踪导线弯曲来测量组织收缩。EHTs 的形成也在受限的微流体通道中实现,以将细胞成本降低到每个组织数千个细胞(图 4d),可通过在明场显微镜下光学跟踪跳动运动来间接表征组织收缩。
(二)3D 心脏球体的收缩力测量
无支架的 3D 心脏球状体的形成是基于心肌细胞与基质细胞或成纤维细胞共培养的自组装特性,通过使用悬滴法或无粘性微基质产生。与基于视频的心肌细胞分析方法类似,记录组织收缩引起的球状体形状变化的时间序列图像,应用边缘检测算法检测自发收缩或电刺激下收缩时球状体边界的动态变化。组织收缩的幅度被计算为心脏球状体在收缩和舒张状态下的面积变化的分数(图 4e)。然而,球状体的可见形状变化并不直接与组织收缩力或应力相关。其他因素,如细胞密度、组织成分和培养时间,也可能影响球状体收缩时尺寸变化的大小。此外,不均匀的组织尺寸、心脏球状体的旋转和平面外方向的形状变化也会导致测量误差。
(三)微型心室模型的收缩力测量
为了模仿心室的三维结构和泵送功能,建立了体外心室模型。测量基于压力和体积的指标,以代表工程心室的收缩或泵送性能,与器官生理学相关。研究人员用人类多能干细胞衍生的心室心肌细胞创造了一个功能性的微型人类心室类器官室(hvCOC),如图 4f 所示。通过将心肌细胞包埋的水凝胶加入到由琼脂糖外边界和气球核心组成的模具中,形成了壁厚为 100 µm 的空心室。同时采集了腔内产生的振荡压力和腔内容积的周期性变化以评价收缩功能。此外,与二维和其他三维模型相比,hvCOCs 显示参与 Ca2+ 处理的蛋白、离子通道和心脏特异性蛋白的表达上调,对药物干预的敏感性增强。需要注意的是,各向同性的心肌细胞在基于胶原的水凝胶中的分布,在再现原生心肌的有组织的层状结构方面仍存在局限性。
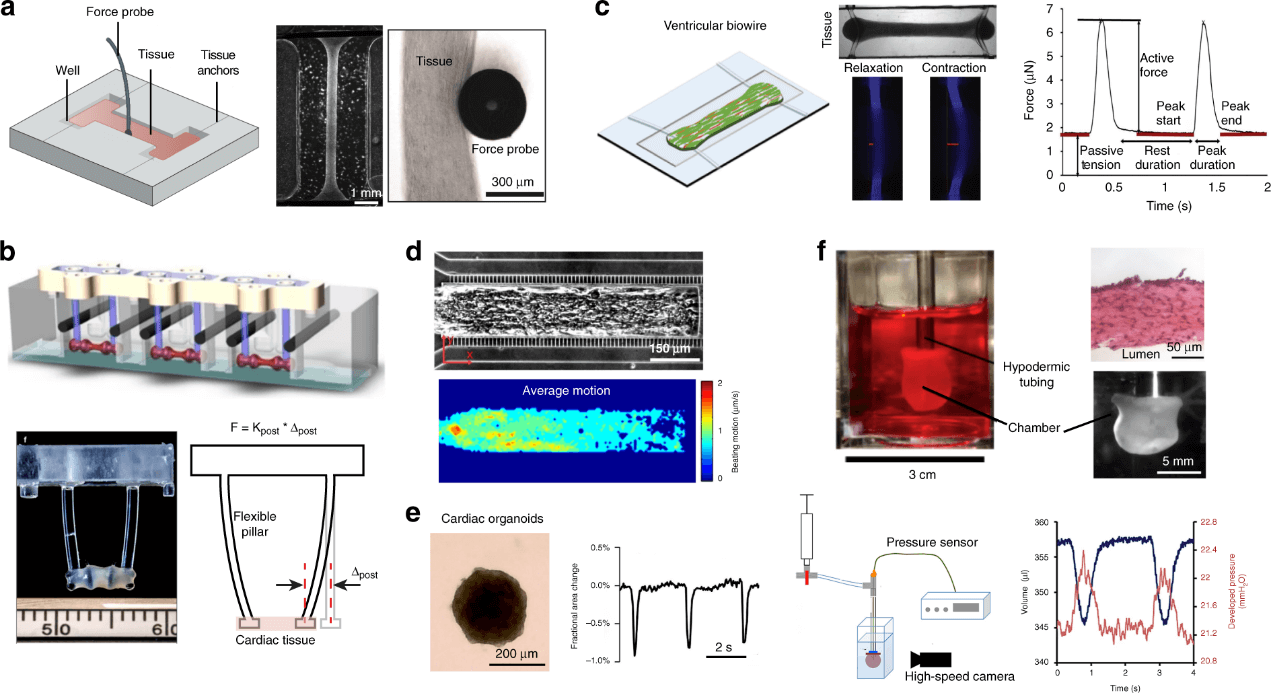 图4. 3D 工程心脏组织(EHT)的收缩功能测量。
图4. 3D 工程心脏组织(EHT)的收缩功能测量。
多能干细胞技术和心脏芯片平台的出现为在细胞培养中模拟人类心脏生理学和病理学铺平了道路。心肌细胞的收缩力是反映正常或患病心脏功能的关键参数,也是评估药物干预效果所必需的参数。在这篇文章中,我们描述了各种新兴方法,这些方法已被开发用于在细胞和组织水平上评估体外心脏模型的收缩功能。简要介绍了通过直接测量收缩应力、收缩力和腔室压力或通过间接测量跳动速度、跳动位移、跳动应变、肌节缩短和阻抗变化来量化体外心脏模型的收缩性的现有平台。对平台设计、制造方法、传感原理、细胞类型和模型配置也进行了简单描述。需要注意的是,体内的细胞生理结构和微环境比体外更为复杂,而生物物理和生物化学微环境在指导心脏发育、维持平衡和调节发病过程中起着关键作用,因此有必要将受控的微环境刺激与生物传感技术结合起来,研究生理和病理生理条件下的心脏细胞/组织重塑过程。未来的研究有望进一步筛选和阐明不同微环境线索在指导细胞发育、功能特性和发病过程中的综合作用,实现连续、多参数和高通量的心脏模型功能测量,更全面地概括原生体内条件并反映不同细胞和器官类型之间的整体相互作用,进一步促进对疾病机制的研究以及开发更精准和有效的治疗模式。
原文链接:https://www.nature.com/articles/s41378-021-00344-0
作为全球优质的临床前药物开发服务供应商,安必奇生物拥有丰富的体外模型构建、器官芯片开发等代理经验。提供优质、完善的器官芯片设计及开发服务,以帮助客户获取高仿、节能的生理学研究及药物开发工具。目前已建立能够模拟心脏、肝脏、肺、肾、脑、肠等器官的微结构和功能的芯片模型。可从材料、制备技术、仪器、以及商业化等方面实现个性化定制。欢迎免费咨询!
24小时服务在线

