血脑屏障是介于血液与脑组织之间的一道生理屏障,由毛细血管的内皮、基膜和星形胶质细胞的血管周足等构成,其可以选择性地调控某些分子进出脑组织,在维持脑组织的内环境稳和神经系统的生理功能方面具有至关重要的作用。例如,血脑屏障可调控一些营养物质,如氧气、葡萄糖等进入脑组织,但是也能阻止一些外源的物质,如微生物、毒素等侵入脑组织。目前,许多临床研究表明,血脑屏障的功能障碍与多种脑疾病(如阿尔兹海默病、脑肿瘤和帕金森病)的发生密切相关。而且由于血脑屏障致密性的结构和对分子的选择透过性特征,也使得多种临床药物无法通过血脑屏障而发挥治疗作用,这给脑部疾病治疗和控制带来很大的挑战。近年来,随着细胞培养技术和微流控技术的发展,构建一种有效可靠的模拟体内环境的体外血脑屏障-器官芯片模型成为可能,该模型为开展脑疾病病理机制研究以及相应疾病药物开发提供了可靠有力的工具。
安必奇生物能够构建一系列接近人体生理过程的缩微组织器官类型,如心脏、血管、肾脏、骨和脑等。我们的科研团队在血脑屏障-器官芯片模型的构建方面拥有广泛的行业知识和经验,能够结合传统的细胞培养方法与微加工和微流体技术,构建稳定性高、重复性高、生理功能接近体内的体外血脑屏障-器官芯片模型,为开展重大脑部疾病的研究和新药开发与筛选提供新的策略。
血脑屏障-器官芯片模型是指结合微流控芯片技术和细胞培养技术,在体外构建高保真地模拟体内血脑屏障的复杂结构和生理功能的微型仿生系统,其对各种临床脑部疾病的研究以及相应疾病的药物开发与筛选具有重要的意义。与传统的体外静态和动态的血脑屏障模型相比,血脑屏障-器官芯片模型具有许多优点:
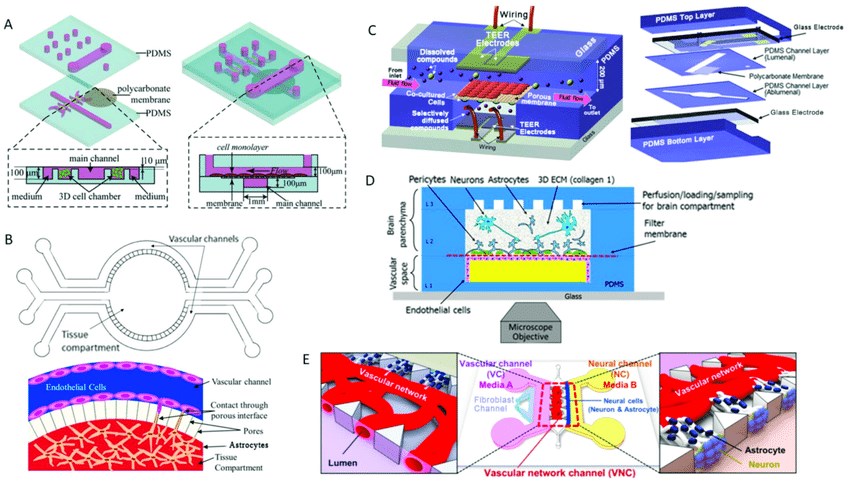 图1. 血脑屏障-器官芯片模型示意图。(John, 2018)
图1. 血脑屏障-器官芯片模型示意图。(John, 2018)
安必奇生物致力于人体器官芯片模型的构建及应用研究,能够将微流控技术与细胞生物学、生物材料和干细胞技术相结合,建立高仿真的心脑屏障模拟系统,用于脑部疾病发病机制研究、新药药效动力学及药代动力学的评估、毒理学的研究等。我们提供“一站式”的血脑屏障-器官芯片模型构建服务,包括微流控芯片的设计与制作、血脑屏障模型细胞的培养到模型的鉴定及评估,能为您设计和定制满足项目要求的多种血脑屏障-器官芯片模型。
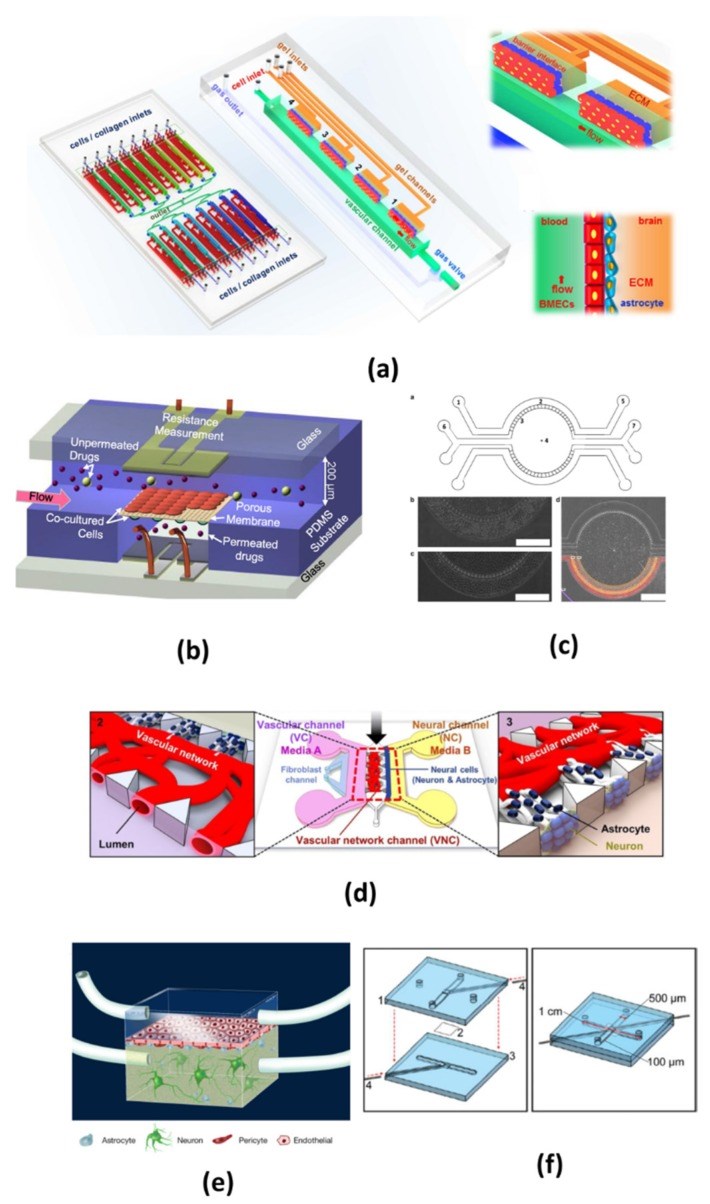 图2. 微流控芯片血脑屏障体外模型的典型设计。(Jiang, 2019)
图2. 微流控芯片血脑屏障体外模型的典型设计。(Jiang, 2019)
安必奇生物从事器官芯片模型的设计、研发、加工及咨询服务,能为客户提供一对一的技术咨询、器官芯片整体方案设计和制造服务。我们的科研团队在血脑屏障-器官芯片模型构建方面拥有前沿的理论知识,可以利用微流控技术控制流体流动,结合细胞生物学和生物材料及工程学方法,在芯片上构建接近体内环境的血脑屏障-器官芯片模型。如果您想了解更多关于血脑屏障-器官芯片模型的内容,可以随时与我们联系。
参考文献:
24小时服务在线

